Nel testo "Titolo o percentuale di massa” abbiamo visto come calcolare il rapporto tra la massa del soluto e la massa della soluzione, per soluzioni solide, liquide e gassose. In questo testo però vedremo che è possibile calcolare anche il titolo in termini di volume, per soluzioni con componenti liquidi o gassosi.

Il titolo in volume può essere calcolato con l'espressione:
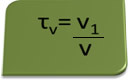
Si consideri ad esempio una soluzione acquosa di alcol etilico usata come antisettico e disinfettante, che era preparato aggiungendo 70 ml di alcool puro a una quantità d'acqua sufficiente a raggiungere un volume di 100 ml di soluzione. Quindi abbiamo:
τ = 70 ml = 0,7
100 ml
Possiamo esprimere il titolo anche in percentuale, semplicemente moltiplicando il risultato per 100%. Quindi in questo caso abbiamo una soluzione di alcol etilico al 70%, il che significa che su 100 unità di volume della soluzione, 70 unità di volume sono alcol.
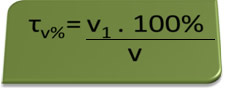
Nel caso seguente, abbiamo una soluzione di alcol etilico al 70% in un volume di soluzione di 250 mL; il che significa che 175 ml sono alcol, secondo i calcoli:
100 ml 70 ml alcol
250 ml x
x = 70. 250
100
X = 175 ml di alcol

Tuttavia, non possiamo dire che in questo caso abbiamo 75 ml (250-175) di acqua. A differenza del titolo in massa, in cui possiamo aggiungere la massa del solvente alla massa del soluto per trovare la massa della soluzione, questo non può essere fatto in relazione al titolo in volume.

Non fermarti ora... C'è dell'altro dopo la pubblicità ;)
Ciò significa che il volume della soluzione non è uguale alla somma del volume del solvente e del volume del soluto (sebbene spesso la differenza possa essere considerata trascurabile). Questo perché le forze intermolecolari che esistono in questi liquidi influenzano il volume finale.
Nel caso della suddetta soluzione, ad esempio di alcool etilico, quando mescoliamo alcool con acqua, si ha una contrazione del volume totale della soluzione; cioè, il volume finale sarà più piccolo che se aggiungessimo solo il volume di alcol e acqua. Questo perché le molecole di alcol stabiliscono legami o legami idrogeno con le molecole d'acqua, riducendo gli spazi tra di loro.
Pertanto, in questo e in altri casi, il volume della soluzione deve essere misurato sperimentalmente quando non previsto nell'esercizio.
La percentuale in volume è ampiamente utilizzata nei casi di bevande alcoliche e alcolici commerciali, come sopra menzionato. Vedi due importanti applicazioni di questo calcolo:
- Etilometro: l'etilometro misura la concentrazione di alcol etilico nel sangue, e in Brasile è vietato a chiunque guidare qualsiasi tipo di veicolo con un tasso alcolemico pari o superiore allo 0,1% in volume. Una persona con questa gradazione alcolica ha, per ogni litro di sangue, 1 ml di alcol, come risulta dai seguenti calcoli:
τv%=V1. 100%
v
0,1 % = V1. 100%
1L
V1 = 0,1% → V1 = 0,001 l = 1 ml
100%

- Contenuto di etanolo nella benzina: in Brasile la benzina è regolata dall'aggiunta di etanolo. Ma il contenuto di etanolo nella benzina deve essere al massimo il 24% in volume di alcol anidro (poiché la benzina deve essere priva di acqua). Più etanolo viene aggiunto alla benzina, più il colore del carburante diventa più chiaro e la sua densità aumenta.
di Jennifer Fogaça
Laureato in Chimica
Vorresti fare riferimento a questo testo in un lavoro scolastico o accademico? Guarda:
FOGAÇA, Jennifer Rocha Vargas. "Titolo del volume di una soluzione chimica"; Scuola Brasile. Disponibile in: https://brasilescola.uol.com.br/quimica/titulo-volume-uma-solucao-quimica.htm. Consultato il 28 giugno 2021.
Chimica

Come funziona l'etilometro, concentrazione di alcol, etilometro, reazioni che coinvolgono l'alcol etilico, tipi di etilometro, dicromato di potassio, cella a combustibile, catalizzatore, rilascio di elettroni, acido acetico, idrogeno, concetto


