HAI Menyetarakan persamaan oksidasi-reduksi itu didasarkan pada kesetaraan jumlah elektron yang diberikan dengan jumlah elektron yang diterima. Metode sederhana untuk melakukan penyeimbangan ini diberikan oleh langkah-langkah berikut:
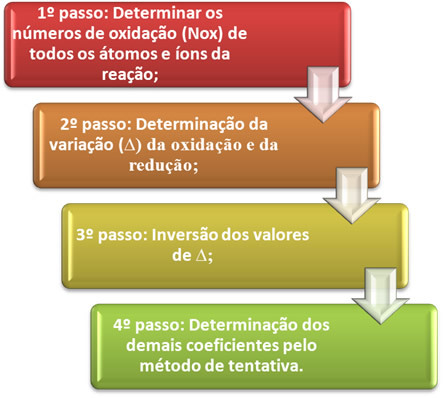
Mari kita lihat dalam praktek bagaimana menerapkan langkah-langkah tersebut, melalui contoh berikut:
Reaksi antara larutan berair kalium permanganat dan asam klorida:
kmnO4 + HCl → KCl + MnCl2 + Cl2 + H2HAI
*langkah pertama:Tentukan bilangan oksidasi:
Langkah ini penting karena kita biasanya tidak dapat dengan cepat memvisualisasikan spesies mana yang mengalami oksidasi dan reduksi.
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
kmnO4 + HCl → KCl + MnCl2 + Cl2 + H2HAI
*langkah ke-2:Penentuan variasi oksidasi dan reduksi:

Perhatikan bahwa mangan (Mn) direduksi dan klorin (Cl) dioksidasi.
MnCl2 = Nox = 5
Cl2 = Nox = 2
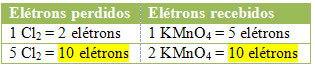
Dalam kasus klorin, kita dapat mencatat bahwa HCl menimbulkan 3 senyawa (KCl, MnCl2, dan Cl2), tetapi yang menarik bagi kami adalah Cl2, karena Nox Anda yang mengalami variasi. Setiap klorin yang membentuk Cl
2 kehilangan 1 elektron; bagaimana dibutuhkan 2 klorin untuk membentuk setiap Cl2, maka dua elektron hilang.langkah ke-3:Inversi nilai :
Pada langkah ini, nilai dipertukarkan antara spesies yang disebutkan, menjadi koefisiennya:
MnCl2 = Nox = 5 → 5 akan menjadi koefisien Cl2
Cl2 = Nox = 2→ 2 akan menjadi koefisien MnCl2
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2HAI
Pada titik ini, sudah mungkin untuk mengetahui dua koefisien persamaan.
Pengamatan: biasanya, di sebagian besar reaksi, pembalikan nilai ini dilakukan pada anggota pertama. Tetapi, sebagai aturan umum, ini harus dilakukan pada anggota yang memiliki jumlah atom paling banyak yang mengalami redoks. Jika kriteria ini tidak dapat dipenuhi, kami membalikkan nilai untuk anggota dengan jumlah spesies kimia tertinggi. Inilah yang dilakukan di sini, karena anggota ke-2 memiliki lebih banyak zat.
Jangan berhenti sekarang... Ada lagi setelah iklan ;)
langkah ke-4: Penyeimbangan percobaan:
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2HAI
- Karena di anggota kedua ada dua atom mangan, seperti yang ditunjukkan oleh koefisien, di bagian pertama juga harus ada. Jadi kita punya:
2 kmnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2HAI
- Jadi, jumlah kalium (K) di anggota pertama adalah 2, yang akan menjadi koefisien yang sama untuk atom ini di anggota kedua:
2 kmnO4 + HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2HAI
- Jumlah klorin (Cl) dalam anggota ke-2 adalah 16 total, sehingga koefisien HCl dari anggota ke-1 adalah:
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2HAI
- Jumlah hidrogen pada anggota pertama adalah 16, maka koefisien air (H2O) dari anggota ke-2 akan sama dengan 8, karena perkalian indeks hidrogen (2) dengan 8 sama dengan 16:
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2HAI
- Untuk memeriksa apakah persamaan tersebut seimbang dengan benar, kita dapat melihat dua kriteria:
1) Periksa apakah jumlah masing-masing atom dalam dua anggota sama:
2 kmnO4 + 16 HCl →2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2HAI
K = 2K = 2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
2) Lihat apakah jumlah total elektron yang hilang sama dengan jumlah total elektron yang diterima:
Oleh Jennifer Fogaa
Lulus kimia
Apakah Anda ingin mereferensikan teks ini di sekolah atau karya akademis? Lihat:
FOGAÇA, Jennifer Rocha Vargas. "Penyeimbangan pengurangan Roxi"; Sekolah Brasil. Tersedia di: https://brasilescola.uol.com.br/quimica/balanceamento-por-oxirreducao.htm. Diakses pada 28 Juni 2021.


