asam adalah zat yang terionisasi dalam media berair dan baik konduktor kekuasaan. Keasaman suatu zat dapat diukur melalui teknik pengukuran potensial ion hidrogen (pH) dari suatu larutan. Beberapa metode analisis pH menggunakan indikator seperti lakmus atau fenolftalein, yang mencerminkan nilai pH larutan dalam warna.
Asam dapat dicirikan:
oleh ada atau tidaknya oksigen dalam molekulnya;
dengan paksa;
oleh hidrogen yang dapat terionisasi;
oleh volatilitasnya.
Baca juga:Perbandingan antara asam dan basa - perbedaan dan sifat
Karakteristik asam
Mereka terionisasi dalam media berair, melepaskan kation H+.
Mereka adalah konduktor listrik karena pelepasan ion dalam media air.
Dalam kontak dengan lingkungan dasar, mereka menderita reaksi netralisasi, membentuk garam dan air sebagai produk dari reaksi ini.
Mereka mengubah warna larutan dengan adanya zat indikator seperti lakmus atau fenolftalein.
Rasa asam lemon, jeruk, di antara buah jeruk lainnya, disebabkan oleh asam yang ada dalam makanan ini.
Jangan berhenti sekarang... Ada lagi setelah iklan ;)
Potensi hidrogen (pH)
Potensi ion hidrogen (pH) adalah perhitungan yang menyatakan konsentrasi ion dari hidrogen dalam tertentu larutan. Untuk menentukan pH dan menganalisis media, hal-hal berikut diperhitungkan:
Hukum pengenceran Ostwald (semakin diencerkan, semakin banyak ion yang akan terbentuk dalam larutan);
autoionisasi air (Kw), yang merupakan pemecahan alami molekul H H2O dalam ion H+ dan oh-;
air suling pada 25 ° C memiliki autoionisasi Kw = 10-14 dan konsentrasi ion H yang sama+ dan oh-, yaitu, itu adalah media netral.
Untuk perhitungan pH yang melibatkan konsentrasi H+, menggunakan: pH = -log[H+].
Tahu bahwa:
pH > 7 → larutan basa
pH < 7 → larutan asam
pH = 7 atau pH = pOH → larutan netral
Lihat juga: Seperti apa rumus asam?

Klasifikasi asam
ITU klasifikasi asam dapat dilakukan dengan mempertimbangkan empat kriteria yang berbeda.
Derajat ionisasi (α) atau kekuatan asam
α = jumlah molekul terionisasi
jumlah molekul terlarut
Asam kuat: α ≥ 50%.
Contoh: áAC id sulfat (H2HANYA4) → α = 61%.Asam semi kuat atau sedang: 5% < α < 50%.
Contoh: asam fosfat (H3DEBU4) → α = 27%.Asam lemah: α ≤ 5%.
Contoh: asam borat (H3BO3) → α = 0,075%.
→ Jumlah hidrogen yang dapat terionisasi
asam tunggal: melepaskan kation H+.
Contoh: áAC id hidroklorida (HCL);
asam: melepaskan dua kation H+.
Contoh: hidrogen sulfida (H2S).asam triasam: melepaskan tiga kation H+.
Contoh: asam borat (H3BO3).tetrasida: melepaskan empat kation H+.
Contoh: asam pirofosfat (H4P2HAI7).
Perhatian! Dalam kasus hidrat, semua hidrogen dalam molekul dapat terionisasi; tetapi dalam kasus asam oksi, hanya hidrogen yang terikat pada atom oksigen yang dapat terionisasi. Contohnya adalah asam hipofosfat (H3DEBU2), yang merupakan asam mono karena, meskipun memiliki tiga hidrogen dalam komposisinya, ia hanya melepaskan hidrogen yang terikat pada oksigen.
→ Kehadiran oksigen
asam oksi: memiliki oksigen dalam strukturnya.
Contoh: asam hipoklorit (H2O Cl).
Hidracid: tidak memiliki oksigen dalam strukturnya.
Contoh: asam fluorida (HF).
→ Volatilitas
Tetap: titik didih(KAKI) > 100 °C, perlahan berubah menjadi gas.
Contoh: asam sulfat (H2HANYA4) → PE = 340 °C.volatil: titik didih < 100 °C, berubah dengan cepat dan mudah menjadi gas.
Contoh: hidrogen sulfida (H2S) → PE = -59,6°C.
Tatanama asam
→ Hidracids
Asam + nama anion + hidrat
Untuk semua asam, istilah "asam" digunakan sebelum nomenklatur yang mencirikan molekul. Dalam hydracids, akhiran "eto" dari nama elemen diganti dengan "hydric".
Contoh:
HCl → AC id klorinhidrik
HBr → AC id bromhidrik
HF → AC id fluorhidrik
→ asam oksi
Nomenklatur asam oksi bervariasi sesuai dengan bilangan oksidasi (NOX) dari elemen pusat. Lihat tabel di bawah ini:
NOX dari elemen pusat |
Tatanama asam |
||
awalan- |
-infiks- |
-akhiran |
|
+1 dan +2 |
kuda nil- |
-nama anion- |
-so |
+3 dan +4 |
-- |
Nama anion- |
-so |
+5 dan +6 |
-- |
Nama anion- |
-ic |
+7 |
Per |
-nama anion- |
-ic |
Contoh:
HClO → Mengetahui bahwa hidrogen (H) biasanya memiliki NOX +1 dan oksigen (O) memiliki NOX -2, bagi kita untuk memiliki molekul bermuatan 0, klorin (Cl) harus memiliki NOX +1, sehingga penamaan asam ini adalah asam hipoklorit.
HNO2 → asam nitrit
HClO4 →áAC idperklorat
→ Pengecualian untuk aturan
H2CO3 → asam karbonat, dan tidak mengandung karbon, karena akan berada di bawah aturan NOX.
H3BO3 → áAC id borat, dan tidak membosankan.
Asam dalam kehidupan sehari-hari
Pupuk dan Obat-obatan: Asam fosfat (H3DEBU4) banyak digunakan dalam pembuatan pupuk dan juga sebagai obat. Ini adalah salah satu dari beberapa asam yang digunakan di bidang farmasi.
Buah sitrus: memiliki asam askorbat (C6H8HAI6), juga dikenal sebagai Vitamin C.
Cuka: ada dalam komposisinya Asam asetat (CH3COOH).
- Air soda dan minuman ringan: terdiri dari asam karbonat (H2BERSAMA3), yang memberikan sensasi menyegarkan pada produk.
Juga akses:Peran asam dalam minuman ringan

latihan yang diselesaikan
Pertanyaan 1 - (Enem) Jus yang diekstrak dari kubis merah dapat digunakan sebagai indikator karakter asam (pH antara 0 dan 7) atau basa (pH antara 7 dan 14) dari larutan yang berbeda. Dengan mencampurkan sedikit jus kubis dan larutan, campuran mulai menunjukkan warna yang berbeda, sesuai dengan sifat asam atau basanya, sesuai dengan skala di bawah ini.
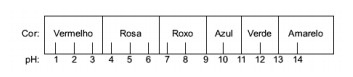
Beberapa solusi diuji dengan indikator ini, menghasilkan hasil sebagai berikut:
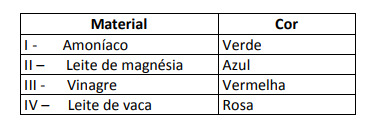
Menurut hasil ini, solusi I, II, III dan IV masing-masing memiliki karakter berikut:
A) asam/basa/basa/asam.
B) asam/basa/asam/basa.
C) basa/asam/basa/asam.
D) asam/asam/basa/basa.
E) Basa / Basa / Asam / Asam.
Resolusi
Alternatif E Untuk menentukan apakah zat tersebut bersifat asam, basa, atau bahkan netral, dilakukan analisis warna yang diperoleh dalam pengujian dalam kaitannya dengan data skala yang diberikan. Mengetahui bahwa larutan dengan pH = 7 bersifat netral, pH > 7 bersifat basa dan dengan pH <7 bersifat asam, kita sampai pada kesimpulan bahwa amonia dan susu magnesium adalah zat dasar, dan cuka dan susu sapi adalah asam.
Pertanyaan 2 - (PUC-Camp) Mengenai zat yang disebut asam, seorang siswa mencatat ciri-ciri sebagai berikut:
I - memiliki kekuatan korosif;
II - mampu menetralkan basa;
III - terdiri dari dua unsur kimia;
IV - membentuk larutan berair yang menghantarkan arus listrik.
Dia membuat kesalahan HANYA di
A) I dan II
B) I dan III
C) I dan IV
D) II dan III
E) III dan IV
Resolusi
Alternatif B Tidak semua asam bersifat korosif, hanya yang terkuat, dan asam dapat terdiri dari dua atau lebih atom.
oleh Laysa Bernardes
guru kimia
Apakah Anda ingin mereferensikan teks ini di sekolah atau karya akademis? Lihat:
ARAúJO, Laysa Bernardes Marques de. "Asam"; Sekolah Brasil. Tersedia di: https://brasilescola.uol.com.br/quimica/acidos.htm. Diakses pada 27 Juni 2021.