Di gaya antarmolekul, secara umum disebut Pasukan Van der Waals, ada tiga: dipol terinduksi dipol, ikatan hidrogen dan dipol permanen-dipol permanen. Dalam teks ini, kami hanya akan mempertimbangkan yang terakhir dari tiga kekuatan ini:
Kekuasaan dipol permanen-dipol permanen, atau sederhananya, dipol-dipol hanya terjadi di molekul polar, yaitu yang tidak memiliki distribusi beban yang seragam di sepanjang permukaannya. Sebagai contoh, dalam molekul HCl (gas hidroklorik) awan elektronik lebih tergeser ke arah atom klorin, karena lebih elektronegatif daripada hidrogen.
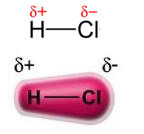
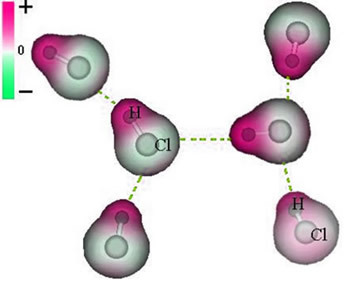
Perhatikan bahwa di sekitar atom klorin ada akumulasi elektron, yang menyebabkan pembentukan a kutub negatif, yang dilambangkan dengan huruf Yunani delta (-δ). Akibatnya, di daerah sekitar atom hidrogen a kutub positif (+δ), karena memiliki kerapatan elektronik yang rendah. Molekul HCl kemudian membentuk dipol listrik dan, oleh karena itu, ketika bersentuhan dengan molekul HCl tetangga lainnya, ada gaya tarik-menarik antara kutub molekul yang berlawanan, seperti dapat dilihat di bawah ini:
Jangan berhenti sekarang... Ada lagi setelah iklan ;)
Gaya tarik menarik ini, yang terbentuk antara ujung negatif dipol satu molekul dengan ujung positif dipol molekul lain, membentuk gaya dipol-dipol..
Jadi, seperti namanya, dipol bersifat permanen, sehingga hanya terjadi pada senyawa polar. Dan semakin tinggi polaritas suatu molekul, semakin intens interaksi dipol-dipol dalam zat tersebut.
Jika dalam fase padat, pembentukan dipol permanen memandu posisi setiap molekul dalam ruang, membentuk kristal dipolar; seperti dalam kasus hidrogen bromida yang diilustrasikan di bawah ini:
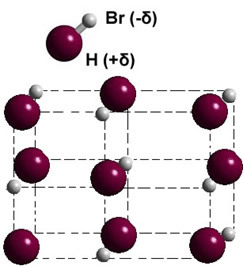
Contoh lain dari zat polar yang memiliki kekuatan dipol-dipol antara molekulnya adalah: H2S, CO, HCl3, HANYA2.
Gaya antarmolekul ini sebesar intensitas sedang, karena lebih kuat daripada gaya tarik-menarik dipol yang diinduksi dipol, tetapi kurang kuat daripada ikatan hidrogen. Inilah sebabnya mengapa titik leleh dan titik didihnya lebih tinggi daripada zat yang memiliki kekuatan dipol induksi. Karena gaya dipol permanen lebih kuat, maka perlu untuk memasok lebih banyak energi agar interaksi molekulnya terurai.
Oleh Jennifer Fogaa
Lulus kimia
Apakah Anda ingin mereferensikan teks ini di sekolah atau karya akademis? Lihat:
FOGAÇA, Jennifer Rocha Vargas. "Gaya antarmolekul dipol-dipol"; Sekolah Brasil. Tersedia di: https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm. Diakses pada 27 Juni 2021.
e) OS2, HBr, HCl, H2HAI.
c) Mengetahui bahwa suhu didih CH3Cl dan CH3I adalah 24,0 °C dan 42,4 °C, masing-masing, menunjukkan senyawa mana yang menyajikan, dalam fase cair, gaya antarmolekul yang lebih kuat.