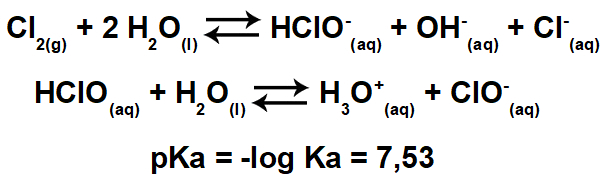Hasil kali kelarutan (Kps) adalah konstanta kesetimbangan yang berhubungan dengan kelarutan zat terlarut.
Situasi ini terjadi pada garam yang sukar larut dalam air, di mana produk dari konsentrasi molar ion adalah konstan, yang kita sebut produk kelarutan.
Perhitungannya terkait dengan kesetimbangan disolusi dan konsentrasi ion dalam larutan. Ini karena jika padatan bersifat ionik, pelarutan ionik dalam air akan terjadi.
Lihatlah contoh perak klorida:
AgCl(s) Ag+ (aq) + Cl- (sini)
Perak klorida padat memiliki kelarutan yang sangat rendah dalam air. Ketika ditempatkan dalam larutan berair, Ag terbentuk+ (aq) dan Cl-(aq).
Setelah beberapa saat dalam larutan, perak klorida padat berdisosiasi dengan laju pembentukan yang sama dengan ion Ag+ dan Cl-. Pada saat itu, keseimbangan tercapai, yang dapat dihitung.
Bagaimana cara menghitung Kps?
Perhitungan Kps dapat kita nyatakan sebagai berikut:
ApBq pAq+. qBP-
Kps = [Aq+]P. [BP-]apa
Lihat contoh dengan timbal bromida II:
PbBr2 Pb+2 (aq) + 2 Br-1 (sini)
Kps = [Pb2+]. [Br-1]2
Baca juga:
- larutan kimia
- Konsentrasi solusi
- Kelarutan
- koefisien kelarutan
Latihan Soal
1. Pada 36,5 °C kelarutan barium sulfat dalam air (BaSO4(aq)) sama dengan 1.80.10-5 perempuan jalang. Hitung produk kelarutan garam ini pada 36,5 °C.
Resolusi:
BASO4(s) Ba2+ (aq) + SO4-2 (sini)
Kps = [Ba2+]. [HANYA4-2]
Kps = (1.80.10-5 perempuan jalang). (1,80.10-5 perempuan jalang)
Kps = 3.24.10-10
2. (FUVEST) Pada suhu tertentu, kelarutan perak sulfat dalam air adalah 2.0.10-2 perempuan jalang. Berapakah nilai hasil kali kelarutan (Kps) garam ini pada suhu yang sama?
Resolusi:
Ag2HANYA4 ⇔ 2 Ag+ + 1 HANYA4-2
Kps = [Ag+]2. [HANYA4-2]
Untuk mengetahui kelarutan masing-masing ion, mari kita buat perbandingan sebagai berikut:
1 Ag2HANYA4 = 2,0.10-2 mol/L, maka: 2 Ag+ = 4,0.10-2 mol/L dan 1 HANYA4-2 = 2,0.10-2 perempuan jalang
Sekarang ganti saja nilai-nilai dalam persamaan:
Kps = [4 x 10-2]2 . [2x10-2]
Kps = 16 x 10-4 . 2x10-2
Kps = 32 x 10-6
Kps = 3,2 x 10-5
Tabel Produk Kelarutan
Nilai Kps bervariasi dengan suhu, zat memiliki Kps konstan pada suhu tertentu. Lihat beberapa contoh Kps pada 25 °C:
| Zat | Rumus | Kps |
|---|---|---|
| timbal sulfida | PbS | 3,4.10-28 |
| perak sulfida | Ag2s | 6,0.10-51 |
| aluminium hidroksida | Al(OH)3 | 1,8.10-33 |
| Besi(III) hidroksida | Fe(OH)3 | 1,1.10-36 |
| nikel sulfida | NiS | 1,4.10-24 |
| Barium sulfat | BASO4 | 1,1.10-10 |
Latihan
1. (UFPI) Kelarutan kalsium fluorida pada 18 °C adalah 2,10-5 mol/liter. Produk kelarutan zat ini pada suhu yang sama adalah:
a) 8,0 × 10-15
b) 3,2 × 10-14
c) 4 × 10-14
d) 2 × 10-5
e) 4 × 10-5
Alternatif b) 3,2 × 10-14
2. (Mackenzie-SP) Hasil kali kelarutan kalsium karbonat (CaCO3), yang memiliki kelarutan 0,013 g/L pada 20°C, adalah:
a) 1,69 × 10-4
b) 1,69 × 10-8
c) 1,30 × 10-2
d) 1,30 × 10-8
e) 1,69 × 10-2
Alternatif b) 1,69 × 10-8
3. (PUC-Campinas) Hasil kali kelarutan besi hidroksida, Fe(OH)3, dinyatakan dengan hubungan:
a) [Fe3+] · 3 [OH– ]
b) [Fe3+] + [OH–]3
c) [Fe3+] · [OH–]3
d) [Fe3+] / [OH-]3
e) [Fe-]3 / [OH3+]
Alternatif c) [Fe3+] · [OH–]3