Transformasi isobarik terjadi ketika gas berada pada tekanan konstan. Misalnya, jika dilakukan di lingkungan terbuka, transformasi akan menjadi isobarik karena tekanannya adalah tekanan atmosfer yang tidak akan berubah.
Dalam hal ini, suhu dan volume bervariasi. Dua ilmuwan terkemuka telah mempelajari bagaimana variasi dalam transformasi isobarik ini terjadi. Yang pertama menghubungkan volume dan suhu gas adalah Jacques Charles (1746-1823), pada tahun 1787, dan kemudian, pada tahun 1802, Joseph Gay-Lussac (1778-1850) menghitung hubungan ini.
Dengan demikian, muncul hukum yang menjelaskan transformasi isobarik gas, yang kemudian dikenal sebagai Hukum Charles/Gay-Lussac. Dinyatakan sebagai berikut:
"Dalam sistem dengan tekanan konstan, volume massa tetap gas berbanding lurus dengan suhu."

Ini berarti bahwa jika kita menggandakan suhu, volume yang ditempati oleh gas juga akan berlipat ganda. Di sisi lain, jika kita menurunkan suhu, volume gas juga akan berkurang dalam proporsi yang sama.
Hal ini dapat dilihat dalam percobaan yang sangat sederhana. Jika kita menempatkan balon di leher botol, massa tetap udara akan terperangkap. Jika kita mencelupkan botol ini ke dalam mangkuk berisi air es, balon akan mengempis. Sekarang, jika kita memasukkannya ke dalam mangkuk berisi air panas, balon itu akan terisi.
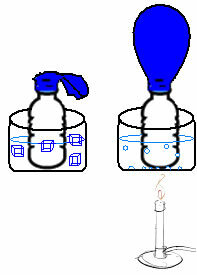
Ini karena ketika suhu meningkat, energi kinetik molekul gas meningkat dan kecepatan pergerakannya juga meningkat. Dengan demikian, gas mengembang, meningkatkan volume yang ditempatinya, dan balon mengembang. Hal sebaliknya terjadi ketika kita menurunkan suhu, memasukkannya ke dalam air dingin.
Hubungan antara suhu dan volume dalam transformasi isobarik diberikan oleh hubungan berikut:
V = k
T
"k" adalah konstanta, seperti dapat dilihat pada grafik berikut:
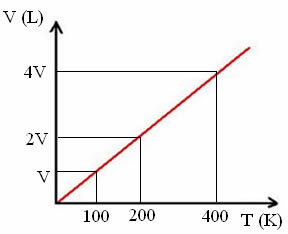
Perhatikan bahwa rasio V/T selalu memberikan konstanta:
_V_ =_2V_ = _4V_
100 200 400
Dengan demikian, kita dapat menetapkan hubungan berikut untuk transformasi isobarik:
Vawal = VTerakhir
Tawal TTerakhir
Ini berarti bahwa ketika ada perubahan suhu gas pada tekanan konstan, kita dapat mengetahui volumenya melalui ekspresi matematis ini. Kebalikannya juga benar, mengetahui volume gas, kita mengetahui berapa suhunya. Lihat contoh:
Sebuah massa gas menempati volume 800 cm3 pada -23°C, pada tekanan tertentu. Berapakah suhu yang dicatat ketika massa gas, pada tekanan yang sama, menempati volume 1,6 L?”
Resolusi:
Data:
Vawal = 800 cm3
Tawal = -23 C, menambahkan ke 273 kita memiliki 250 K (Kelvin)
VTerakhir = 1,6 L
TTerakhir = ?
* Pertama kita harus meninggalkan volume pada unit yang sama. Diketahui 1 dm3 sama dengan 1 liter. seperti 1 dm3 sama dengan 1000 cm3, ternyata 1 liter = 1.000 cm3:
1 L 1000 cm3
x 800 cm3
x = 0,8 L
* Sekarang kami mengganti nilai rumus dan menemukan nilai suhu akhir:
Vawal = VTerakhir
Tawal TTerakhir
0,8_ = 1,6
250 TTerakhir
0,8 TTerakhir = 250. 1,6
TTerakhir = 400
0,8
TTerakhir = 500K
* Pindah ke skala Celcius, kami memiliki:
T (K) = T (°C) + 273
500 = T (°C) + 273
T (°C) = 500 - 273
T (°C) = 227°C
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/transformacao-isobarica.htm


