ITU konstanta ionisasi memberi air(Kw), HAI potensial hidrogen(pH) ini adalah potensial hidroksilion (pOH) mereka Pengukuran penting untuk perhitungan yang melibatkan keseimbangan kimia dalam larutan asam dan basa, serta dalam menentukan konsentrasi ion H+ dan oh- dari solusi yang dimaksud.
Apa itu Kw?
Produk ionik air, atau Kw (ini wcara air — air, dalam bahasa Inggris), adalah konstanta yang digunakan untuk mewakili keseimbangan yang dihasilkan oleh ionisasi air sendiri. Bahkan pada tingkat yang sangat kecil, air terionisasi menghasilkan ion H+ dan oh-, menurut persamaan kimia berikut:
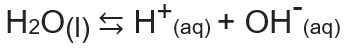
Menganalisis persamaan, kita menyadari bahwa ketika ionisasi dari molekul air murni, ion H dihasilkan.+ dan ion OH-, itu adalah konsentrasi ion-ion ini akan selalu sama. Bahkan ketika ada peningkatan suhu, yang menyebabkan peningkatan laju ionisasi, konsentrasinya tetap sama.
Baca juga:Energi ionisasi
Berdasarkan pengukuran eksperimental, konsentrasi ion H dihitung+ dan oh- (dihasilkan dari ionisasi diri air) pada 25 ° C dan nilai
1. 10-7 perempuan jalang. Itu adalah, dari total 1 miliar molekul air, hanya dua mengalami ionisasi. Hal ini menunjukkan bahwa air murni memiliki derajat ionisasi yang rendah dan menjelaskan yang sangat rendah Konduktivitas listrik dari air murni.Mengingat apa yang ditunjukkan di atas, kita dapat menulis ekspresi konstanta neraca air:

Menggunakan nilai konsentrasi ion H+ dan oh- pada 25 °C, kita dapat menghitung nilai Kw:
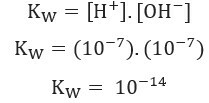
Seperti yang dinyatakan sebelumnya, nilai ini dari Kw berubah dengan meningkatnya suhu, seperti terlihat pada tabel di bawah ini:
T (°C) |
Kw |
10 |
0,29. 10-14 |
20 |
0,68. 10-14 |
25 |
1,00. 10-14 |
30 |
1,47. 10-14 |
40 |
2,92. 10-14 |
60 |
9,40. 10-14 |
Untuk mempelajari lebih lanjut tentang subjek ini, baca teks kami: Produk air ionik.
Apa itu pH dan pOH?

singkatan pH cara potensial hidrogen dan diciptakan oleh ahli biokimia Denmark Soren Sorensen, pada tahun 1909, untuk memfasilitasi pekerjaan dengan konsentrasi ion hidrogen [H+], yang biasanya dinyatakan dalam angka desimal. Untuk mempelajari lebih lanjut tentang topik ini, baca teks kami: Apa itu pH?
Notasi semacam ini menunjukkan kandungan ion H+ hadir dalam larutan dan didefinisikan oleh ekspresi matematika:
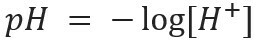
Demikian pula, kita dapat mendefinisikan pOH atau potensial hidroksilionik, yang memberi tahu kita kandungan ion OH-- hadir dalam larutan. Ekspresi matematisnya adalah:
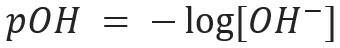
Dalam larutan berair akan selalu ada ion H ++ dan oh- (akibat ionisasi yang dialami oleh air) yang akan digunakan untuk mengkarakterisasi suatu larutan dalam asam atau dasar. Semakin banyak ion H+ ada dalam larutan, semakin asam itu akan. Akibatnya, keberadaan ion OH-- dalam solusi akan membuatnya lebih mendasar. Jika ada keseimbangan dalam jumlah ion-ion ini, larutan akan diklasifikasikan sebagai: netral.
skala pH
Skala pH ditampilkan dengan nilai mulai dari 0 hingga 14 (nilai yang diukur pada 25°C). Lihat skala pH pada gambar di bawah ini:

Semakin rendah pHdari solusi,semakin besar keasamannya, dan semakin dekat ke akhir skala, yaitu, mendekati 14, semakin besar karakter dasarnya. Misalnya, jus lemon memiliki pH 2, sedangkan pemutih memiliki pH 12.
Cara menghitung pH dan pOH
mengetahui konsentrasi ion, kita dapat menghitung nilai pH dan pOH larutan, dan, mengetahui nilai potensial, kami menghitung konsentrasi ion dalam larutan. Untuk tujuan ini, ekspresi berikut digunakan:
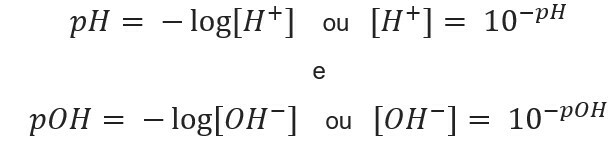
Mari kita pergi ke contoh:
Contoh 1
Jika kita ingin mengetahui pH larutan dengan [H+] = 0,001 mol/L, gunakan saja rumus yang disajikan sebelumnya:
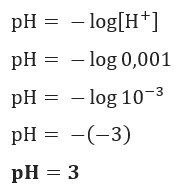
Contoh 2
Sekarang, untuk mengetahui berapa konsentrasi OH- dari larutan dengan pOH = 5, ganti saja nilainya dengan rumus berikut:

Jika kita menerapkan skala potensial yang sama untuk keseimbangan ionik air, kita akan memiliki:
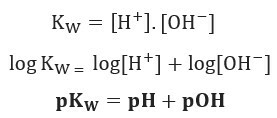
Seperti yang dinyatakan, pada 25 ° C, Kw = 10-14. Karena itu:

Dengan ini, kita dapat menghitung pOH suatu larutan berdasarkan pH-nya. Jika kita memiliki larutan dengan pH 3, maka pOH-nya adalah 11.
Tahu lebih banyak: Media netral, asam dan basa basic
Latihan terpecahkan
Pertanyaan 1 (UEFS-BA) Konsentrasi ion OH–(sini) dalam larutan amonium hidroksida yang diberikan, pada 25 ° C, sama dengan 1,10–3 perempuan jalang. POH larutan tersebut adalah:
a) 0
b) 1
c) 3
d) 11
e) 13
Resolusi: Huruf C. Jika kita memiliki [OH–] = 10–3 mol/L, jadi pOH Anda akan sama dengan 3.
Lihat:
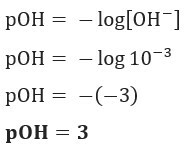
Pertanyaan 2 (UEA-AM) Simak informasi berikut ini, didapat dari label air mineral di kota Porto Seguro (BA):
nitrat 1,45 mg/L
pH pada 25 ° C 4,51
Air mineral ini adalah
a) asam dan memiliki [H+] < [OH–].
b) asam dan memiliki [H+] > [OH–].
c) netral dan memiliki [H+] = [OH–].
d) dasar dan memiliki [H+] > [OH–].
e) dasar dan memiliki [H+] < [OH–].
Resolusi: Huruf b. Karena pH air mineral yang tertera pada label kurang dari 7, kita dapat mengatakan bahwa itu adalah larutan asam dan, oleh karena itu, konsentrasi ion H+ lebih besar dari OH-.
Pertanyaan 3 (UEA-AM) Salah satu cara untuk menghasilkan gas hidrogen dengan cepat di laboratorium adalah dengan mereaksikan bubuk seng logam dengan asam klorida (HCl), pada konsentrasi 1,0 mol/L:
Zn (s) + 2 HCl (aq) → ZnCl2 (aq) + H2 (g)
Menimbang bahwa asam klorida terionisasi 100% dan larutan pada suhu 25 °C, maka benar untuk menyatakan bahwa pH larutan asam klorida yang disebutkan dalam teks adalah
- 0
- 1
- 3
- 13
- 14
Resolusi:Huruf a. Kita dapat menghitung pH larutan menggunakan konsentrasi HCl yang diinformasikan dalam teks, karena, karena terionisasi 100%, konsentrasi [H+] akan sama, karena untuk setiap molekul HCl yang terionisasi, satu ion H+ akan dihasilkan. Karena itu:
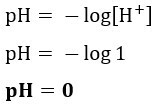
Oleh Victor Ferreira
guru kimia
