Ionisasi adalah reaksi kimia yang menghasilkan ion dari molekul zat yang ditempatkan dalam air.
Jadi, kita dapat mengatakan bahwa ionisasi adalah proses daripembentukan ion.
Asam adalah contoh zat yang mengalami ionisasi ketika ditempatkan dalam air.
proses ionisasi
Lihat bagaimana proses ionisasi terjadi melalui contoh berikut:
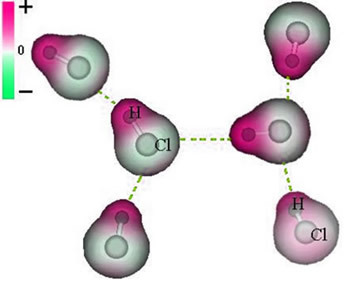
Ketika ditempatkan dalam air, asam klorida (HCl) mengalami ionisasi. Ikatan kimia antara H dan Cl terputus dan ion H terbentuk+ dan Cl-, yang dikelilingi oleh air.
Seperti yang telah kita lihat, H+ kehilangan elektron dan Cl- menerima sebuah elektron. Namun, H+ itu perlu untuk menstabilkan dan sehingga mengikat air.
Dengan demikian, reaksi ionisasi HCl juga dapat direpresentasikan sebagai berikut:
Sekarang kita amati pembentukan kation hidronium (H3HAI+), hasil dari penyatuan H+ dan dari H2HAI.
Penting juga untuk dicatat bahwa dalam contoh ini, Cl menerima elektron karena elektron paling banyak elektronegatif, yaitu, ia memiliki kecenderungan untuk mendapatkan elektron. Oleh karena itu, ia dengan mudah menarik elektron ke dirinya sendiri.
Baca juga:
- elektron
- ion, kation dan anion
- Reaksi kimia
Lihat contoh ionisasi lainnya:
1)
2)
ITU energi ionisasi atau potensial ionisasi adalah sifat periodik yang menunjukkan jumlah energi yang dibutuhkan untuk mentransfer elektron dari atom dalam keadaan dasar.
Disosiasi dan Ionisasi
ITU disosiasi itu adalah fenomena fisik, bukan reaksi kimia. Ini mengacu pada pelepasan ion yang ada dari senyawa ionik dalam air.
Perbedaan utama antara disosiasi dan ionisasi adalah:
- Ionisasi: ion terbentuk;
- Disosiasi: ion-ion yang ada terpisah.
Proses disosiasi hanya terjadi pada garam dan basa. Contoh: NaCl, garam dapur.
Disosiasi dan ionisasi adalah proses penting agar reaksi kimia berlangsung, karena ion bebas lebih reaktif daripada molekul.
Baca juga:
- asam
- garam
- Pangkalan
- keseimbangan ion
- Konsep dan penentuan pH dan pOH
- Reaksi netralisasi
Pastikan untuk memeriksa pertanyaan ujian masuk pada subjek, dengan resolusi komentar, di: latihan tentang fungsi anorganik.