Jika kita menggunakan voltmeter dalam baterai, kita akan dapat mengidentifikasi perbedaan potensial (U atau ddp) atau gaya gerak listrik (ggl atau E) antara dua elektroda. Namun, tidak mungkin untuk mengidentifikasi potensial reduksi atau oksidasi dari masing-masing elektroda dengan cara ini.
Para ilmuwan perlu mengetahui nilai-nilai ini untuk mempelajari proses oksidasi-reduksi, sehingga mereka menetapkan a negara referensi. Ini berarti bahwa telah disepakati untuk mengukur potensi masing-masing elektroda dalam kaitannya dengan elektroda lain di bawah kondisi standar berikut:
• Suhu harus pada 25°C;
• Tekanan pada 1,0 atm;
• Konsentrasi larutan di mana logam direndam harus 1,0 mol/L.
Dengan demikian, elektroda yang dipilih adalah elektroda hidrogen, yang diwakili di bawah ini:
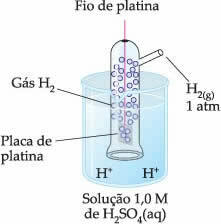
Elektroda ini terdiri dari kawat platina yang dihubungkan ke plat platina, yang tidak ikut bereaksi, di dalam tabung yang berisi gas hidrogen dan direndam dalam larutan asam. Dalam contoh, solusinya adalah asam sulfat.
| Dengan konvensi, elektroda hidrogen standar telah diberi nilai nol, begitu banyak untuk E0merah untuk E0oksi. |
Jadi, untuk menemukan nilai potensial dari elektroda lain, kita cukup membuat tumpukan elektroda yang kita inginkan dengan elektroda hidrogen standar dan mengukur ddp dengan voltmeter. Nilai yang ditampilkan pada voltmeter akan menjadi potensi elektroda yang dicari, karena hidrogen sama dengan nol.
Misalnya, kita menghubungkan elektroda seng dengan elektroda hidrogen untuk mengetahui berapa potensial reduksinya:
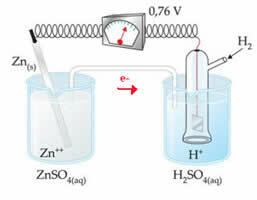
Menurut skema di atas, voltmeter mengidentifikasi perbedaan potensial sama dengan +0,76(?E0 = +0,76). Kami juga mencatat bahwa elektroda seng telah teroksidasi, jadi itu adalah anoda; dan elektroda hidrogen berkurang, menjadi katoda.
Jadi kita punya:
?E0 = E0merah (katoda) - E0 merah (anoda)
0,76 = 0,00 - E0 merah (Zn)
E0 merah (Zn) = 0,00-0,76
E0 merah (Zn) = -0,76
Nilai negatif berarti bahwa arus elektron mengalir dari elektroda seng (anoda) ke elektroda hidrogen, sehingga berperilaku seperti katoda. Jika positif, itu akan menjadi sebaliknya, dan elektroda hidrogen akan berperilaku seperti anoda. Ini dapat dilihat ketika kita menghubungkan elektroda tembaga dengan elektroda hidrogen standar:
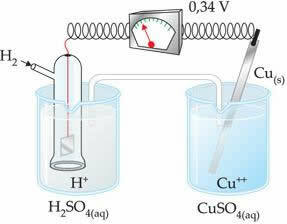
?E0 = E0merah (katoda) - E0 merah (anoda)
-0,34 = 0,00 - E0 merah (Zn)
E0 merah (Zn) = 0,00+0,34
E0 merah (Zn) = +0,34
Dengan demikian, dimungkinkan untuk menentukan potensial reduksi dan oksidasi untuk spesies kimia yang paling bervariasi. Namun, International Union of Pure and Applied Chemistry (IUPAC) merekomendasikan penggunaan potensial reduksi saja. Dan, terlepas dari logam yang digunakan, dalam representasi baterai, elektroda hidrogen selalu didahulukan, misalnya:
Pt – H2 (g) 1atm / H3O1+ (aq) 1 mol/L // Cu2+ (aq) 1 mol/L / Cu
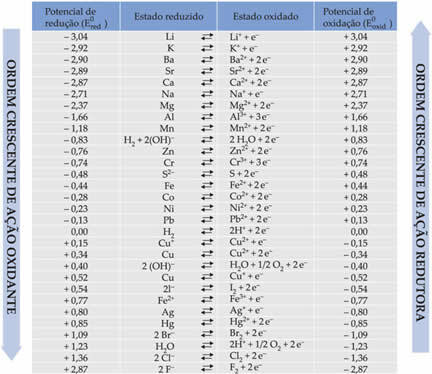
Tercantum di bawah dalam tabel adalah potensi yang dicapai melalui metode ini menggunakan elektroda hidrogen standar, bersama dengan masing-masing semi-reaksi:
Oleh Jennifer Fogaa
Lulus kimia
Tim Sekolah Brasil
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/medicao-dos-potenciais-eletroquimicos.htm

