Karena ada ribuan senyawa organik, fenomena isomerisme dapat mengambil beberapa bentuk. Oleh karena itu, isomerisme pada dasarnya dapat diklasifikasikan menjadi dua jenis: isomerisme datar atau konstitusional dan isomerisme ruang atau stereoisomerisme. Setiap jenis yang disebutkan dapat dibagi lagi, seperti yang ditunjukkan pada diagram berikut:
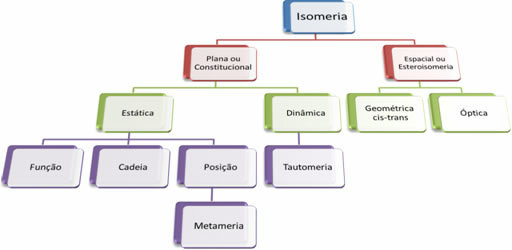
Lihat setiap kasus:
1. Isomerisme Datar atau Konstitusional: Isomer jenis ini memiliki rumus molekul yang sama dan dibedakan oleh rumus struktur datar. Ada lima kasus isomerisme bidang: fungsi, rantai, posisi, metamerisme, dan tautomerisme.
1.1.Isomerisme fungsional atau fungsional: Perbedaan antara isomer adalah pada gugus fungsinya.
Contoh: Rumus molekul C3H6HAI
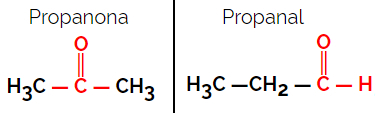
Perhatikan bahwa propanon berasal dari gugus keton dan propanal berasal dari gugus aldehida.
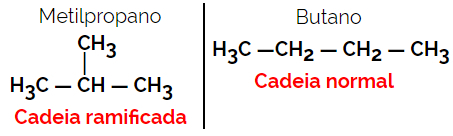
1.2. Isomer rantai atau rangka: Perbedaan antara isomer adalah pada jenis rantai. Misalnya, satu isomer adalah rantai terbuka dan yang lainnya adalah rantai tertutup, atau satu adalah rantai normal dan yang lainnya adalah rantai bercabang, atau satu adalah rantai homogen dan yang lainnya adalah rantai heterogen.
Contoh: Rumus molekul C4H10
1.3.Isomerisme Posisi atau Posisi: Perbedaannya terletak pada posisi tak jenuh, gugus fungsi, heteroatom atau substituen.
Contoh: Rumus molekul C4H6

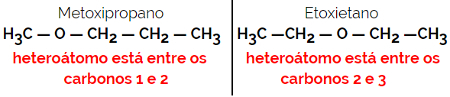
1.4.Kompensasi Isomerisme atau Metamery: Ini adalah jenis khusus dari isomerisme posisi, di mana perbedaannya adalah posisi heteroatom.
Contoh: Rumus molekul C4H10HAI
1.5.Isomer Dinamis atau Tautomeri: Ini adalah jenis khusus dari fungsi isomerisme, di mana isomer hidup berdampingan dalam kesetimbangan dinamis dalam larutan. Dua jenis utama tautomeria adalah antara keton dan enol (keseimbangan ketoenol) dan antara aldehida dan enol (keseimbangan aldoenol).
Contoh: Rumus molekul C3H6HAI
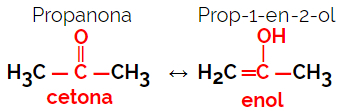
2. Isomerisme Ruang atau Steroisomerisme: Dalam hal ini, perbedaan antara isomer hanya dapat divisualisasikan melalui orientasi atom mereka di ruang angkasa. Ada dua jenis stereoisomerisme: isomer geometri dan isomer optik.
2.1.Isomer geometris atau cis-trans: Perbedaannya adalah isomernya bernama cis ia memiliki ligan karbon yang sama dalam ikatan rangkap atau dalam senyawa siklik pada sisi bidang yang sama. Ligan isomer trans berada di sisi yang berlawanan.
Contoh: Rumus molekul C2H2Cl2

Senyawa ini disebut stereoisomer.
2.2.Isomer optik: Terjadi ketika isomer mampu membelokkan berkas cahaya terpolarisasi. Jika membelokkan berkas cahaya terpolarisasi ke kiri, itu adalah isomer levorotary, tetapi jika membelok ke kanan itu disebut isomer tangan kanan.
Contoh:
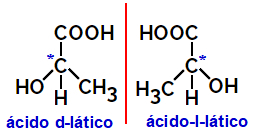
Molekul asimetris seperti yang ditunjukkan di atas, yang merupakan bayangan cermin satu sama lain dan yang tidak dapat ditumpangkan, disebut enansiomer.
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm

