Dalam transformasi isotermal, variasi volume dan tekanan dari gas tertentu, tetapi suhu konstan; maka asal usul nama isotermal (Yunani: iso = sama; termo = panas).
Ilmuwan Boyle dan Mariotte, secara terpisah, melakukan eksperimen serupa dan hasil yang diperoleh adalah: ketika tekanan meningkat, volume gas berkurang.
Pikirkan saja, misalnya, tentang penyedot jarum suntik. Jika kita menerapkan tekanan eksternal pada pendorong ini, yaitu, jika kita meningkatkan tekanan, volume udara yang ditempati di dalam jarum suntik akan berkurang, dan sebaliknya.
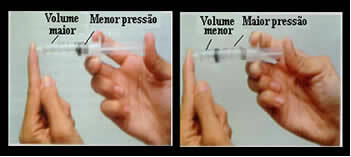
Volume dan tekanan berbanding terbalik: di panel kiri, tekanannya kecil dan volume yang ditempati oleh udara besar. Di sebelah kanan, ketika lebih banyak tekanan diterapkan pada plunger jarum suntik, volumenya berkurang.
Ini bukan kasus yang terisolasi, ini adalah sesuatu yang berulang dengan keteraturan umum untuk gas. Oleh karena itu, fakta ini dituangkan dalam bentuk undang-undang, yang dapat digambarkan sebagai berikut:
| hukum Boyle atau Hukum Boyle-Mariotte: Di bawah suhu konstan, volume yang ditempati oleh massa tetap gas berbanding terbalik dengan tekanannya. |
Ini berarti bahwa jika kita menggandakan tekanan gas, volumenya akan menjadi dua dan seterusnya. Ketika dua kuantitas tersebut berbanding terbalik, produknya adalah konstan; dengan demikian, secara matematis, hubungan ini dapat direpresentasikan sebagai berikut:
| P.V = k |
Dimana k = konstan.
Jadi, jika dalam situasi pertama kita memiliki nilai tekanan gas tertentu sebagai P1 dan volume masing-masing sebagai V1, maka kita harus:
| P1. V1 = k |
Jika kita meningkatkan tekanan ini ke P2, volumenya juga akan diubah menjadi V2 dan sekali lagi kita harus:
| P2 . V2 = k |
Dengan demikian, kami mencapai kesimpulan:
| P1. V1 =P2. V2 |
Keteguhan ini dapat dilihat dengan contoh yang diberikan pada tabel di bawah ini, dari tekanan dan volume gas dengan massa tetap:
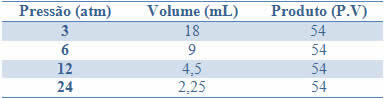
Dengan grafik nilai-nilai ini, kita akan melihat pembentukan kurva.
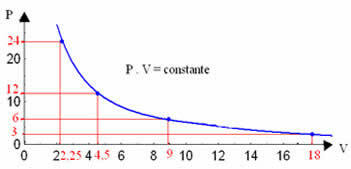
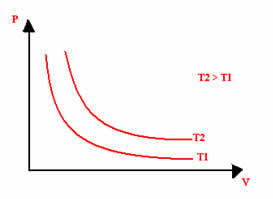
Representasi grafis dari transformasi isotermal akan selalu menjadi hiperbola, terlepas dari nilai tekanan dan volume dan suhu di mana percobaan dilakukan. Hiperbola ini disebut isoterm; jadi, seperti dapat dilihat pada grafik di bawah, suhu yang berbeda menimbulkan isoterm yang berbeda.
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/transformacao-isotermica-ou-lei-boyle.htm

