Mendasarkan aku s zat anorganik yang menurut ahli kimia Swedia Svante Arrhenius, ketika ditempatkan di dalam air, mengalami fenomena disosiasi ionik, di mana ada rilis ion: kation (Y+) dan anion hidroksida (OH-).

Rumus umum basa Arrhenius
grup Y dari mendasarkan itu bisa berupa logam apa saja atau kelompok amonium lainnya (NH4+), yang dilepaskan dalam air sebagai kation selama disosiasi, seperti dapat dilihat pada persamaan yang mewakili proses:
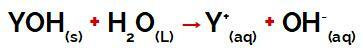
Persamaan yang mewakili disosiasi basa
Lihat di bawah ini beberapa informasi yang sangat penting mengenai klasifikasi dan nomenklatur dari pangkalan.
1) Klasifikasi mengenai kelarutan basa(kemampuan untuk untuk membubarkan di dalam air)
Pangkalan larut: memiliki logam alkali atau amonium dalam komposisi;
Pangkalan sedikit larut: punya logam alkali tanah dalam komposisi. Contoh: magnesium hidroksida, banyak digunakan sebagai antasida dan pencahar;
secara praktis tidak larut: memiliki logam lain dalam komposisi. Contoh: aluminium hidroksida, banyak digunakan sebagai antasida.
2) Klasifikasi mengenai kekuatan akar rumput(kemampuan untuk memisahkan di dalam air)
Pangkalan kuat: memiliki logam alkali atau alkali tanah, dengan pengecualian magnesium, dalam komposisi;
Pangkalan lemah: memiliki logam lain dalam komposisi.
3) Nomenklatur dasar
Untuk memberi nama basis, cukup ikuti aturan penamaan di bawah ini:
Hidroksida + de + nama logam atau amonium
Contoh: Ca(OH)2 → kalsium hidroksida
Jika basa memiliki unsur kimia yang tidak termasuk dalam famili IA, IIA atau IIIA (dan itu bukan perak atau seng), kita harus menunjukkan di depan nama elemen, dalam angka romawi, jumlah hidroksil:
Contoh: Ti (OH)4 → titanium hidroksida IV
Oleh Saya Diogo Lopes
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-base.htm
