A elektrosfer adalah wilayah atom di mana elektron Mereka berada. Elektrosfer, lebih tepatnya, terdiri dari orbital atom, ditentukan dengan menyelesaikan persamaan Schrödinger. Pertama kali ditentukan oleh model Rutherford, elektrosfer mengalami kemajuan yang signifikan selama validitas model atom Bohr.
Elektrosfer dapat dibagi menjadi beberapa lapisan (atau tingkat energi), karena elektron mempunyai energi tertentu (tidak kontinu). Untuk atom dengan dua elektron atau lebih, kulitnya terbagi menjadi subkulit (atau subkulit). Elektrosfer sangat penting untuk memahami sifat-sifat atom dan memahami pembentukan ikatan kimia.
Baca juga: Bagaimana atom terpecah?
Ringkasan tentang elektrosfer
Elektrosfer adalah wilayah atom tempat elektron berada.
Ia terdiri dari orbital atom, fungsi gelombang yang merupakan solusi persamaan Schrödinger.
Konsepnya dimulai dengan model Ernest Rutherford.
Elektron tertahan di elektrosfer karena daya tariknya terhadap inti atom.
Kemajuan utama dalam pemahaman elektrosfer terjadi selama konsepsi model Niels Bohr.
Ini terdiri dari lapisan (atau tingkat energi), yang merupakan wilayah dengan energi tertentu.
Untuk atom dengan lebih dari satu elektron, kulitnya terbagi menjadi subkulit (atau subkulit).
Elektrosfer penting untuk memahami beberapa sifat, seperti kesamaan atom, stabilitas, jari-jari atom, energi ionisasi, afinitas elektron, serta pemahaman pembentukan ikatan bahan kimia.
Pelajaran video tentang elektrosfer
Apa itu elektrosfer?
Elektrosfer didefinisikan sebagai wilayah struktur atom di mana elektron berada. Dalam interpretasi yang lebih mendalam, kita mengatakan bahwa ia terdiri dari orbital atom, fungsi gelombang yang merupakan solusi persamaan Schrödinger. Ekspresi matematis orbital atom, jika dikuadratkan, menyajikan kepadatan probabilitas lokasi elektron pada suatu titik tertentu.
HAI Konsep elektrosfer mulai muncul dengan Model atom Ernest Rutherford, yang menampilkan elektron yang mengorbit di sekitar inti yang padat dan positif. Belakangan, Niels Bohr membawa interpretasi yang lebih signifikan terhadap elektrosfer dengan mencampurkan konsep-konsep dari mekanika kuantum.
Lapisan elektrosfer
Elektron tertahan di elektrosfer karena daya tariknya terhadap inti atom. Namun, hal ini diketahui elektron berada dalam kulit yang energinya terdefinisi dengan baik. Lapisan seperti itu juga bisa disebut tingkat energi.
Kesimpulan ini muncul setelah percobaan spektroskopi. Misalnya bila arus listrik dialirkan ke gas H2 Pada tekanan rendah, cahaya dipancarkan oleh H2. Pada kondisi ini terbentuk ion H+ dan elektron, yang akan kembali menjadi ion H+ dan akan membentuk spesies H+. Untuk menghilangkan kelebihan energi, ion H+ melepaskan energi dalam bentuk radiasi elektromagnetik (cahaya) dan bergabung kembali menjadi gas H2 lagi.
Anda mungkin ingat bahwa ketika cahaya putih melewati prisma, cahaya itu terurai menjadi spektrum kontinu (mirip dengan pelangi); Namun, hal yang sama tidak terjadi pada cahaya yang datang dari H2: ketika radiasi tersebut melewati prisma, hanya garis terang dengan panjang gelombang tertentu yang teramati dalam spektrum emisi H2, yang dikenal sebagai garis spektral.
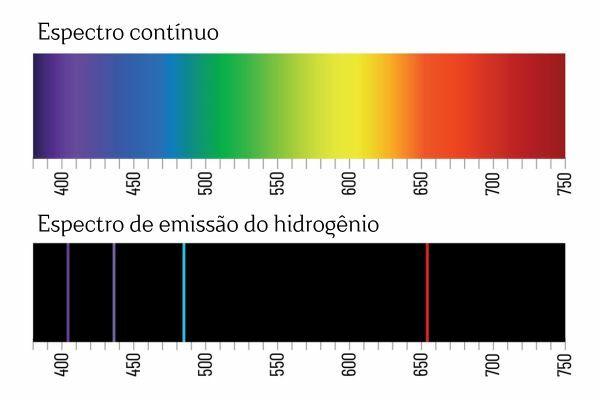
Interpretasi untuk spektrum emisi unsur-unsur (dengan garis spektrum yang terdefinisi dengan baik) adalah sebagai berikut sebuah elektron, dalam sebuah atom, tidak dapat menghadirkan energi apa pun, melainkan dalam jumlah yang terdefinisi dengan baik (disebut paket energi). Jika elektron tidak mempunyai batasan energi seperti itu, spektrum emisi unsur-unsurnya akan kontinu, seperti cahaya putih yang melewati prisma.
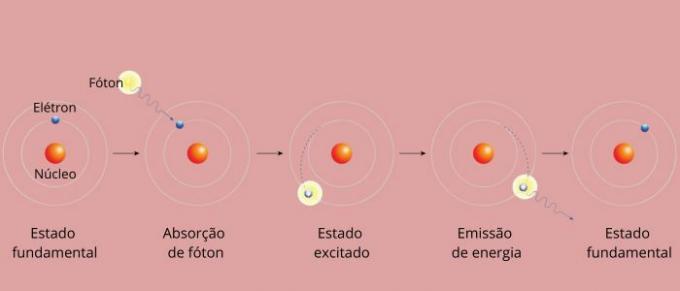
Setiap garis spektral suatu unsur dikenal sebagai tingkat energi. (atau lapisan, seperti yang biasa kita katakan). Garis-garis ini muncul ketika elektron berpindah dari satu tingkat energi yang diizinkan ke tingkat energi lainnya, dalam proses perubahan energi yang dikenal sebagai transisi elektronik.
Selama transisi elektronik, elektron berpindah dari tingkat energi yang lebih rendah ke tingkat energi yang lebih tinggi. Ketika kembali ke tingkat awal, ia memancarkan energi berlebih melalui radiasi elektromagnetik (cahaya), memberi asal garis spektral yang nilai energi yang dipancarkan sebanding dengan nilai yang ditentukan oleh persamaan Rydberg.
Johannes Rydberg adalah seorang ahli spektroskopi Swedia yang menciptakan persamaan untuk menentukan tren garis spektrum berdasarkan karya profesor Swiss Johann Balmer. Energi spesifik setiap lapisan ditentukan dengan menyelesaikan persamaan Schrödinger yang sesuai.
Setiap lapisan elektronik memiliki jumlah elektron yang diperbolehkan. Saat ini, tujuh lapisan elektronik didefinisikan, diidentifikasi dengan huruf K sampai Q, dalam urutan abjad, atau dengan huruf n, di mana n ≥ 1. Jadi, lapisan K adalah lapisan dimana n = 1, dan seterusnya. Jumlah elektron yang diperbolehkan per kulit ditunjukkan pada tabel berikut.
Tingkat energi |
Lapisan |
Jumlah elektron maksimum |
1 |
K |
2 |
2 |
L |
8 |
3 |
M |
18 |
4 |
N |
32 |
5 |
HAI |
32 |
6 |
P |
18 |
7 |
Q |
8 |
Untuk atom hidrogenoid (dengan hanya 1 elektron, seperti H, He+, Li2+), semua orbital atom mempunyai energi yang sama (kita menyebutnya orbital degenerasi); Namun, pada atom dengan dua elektron atau lebih, timbul efek yang sangat penting, yaitu tolakan elektron-elektron. Konsekuensi dari fakta ini adalah orbital setiap lapisan mulai memiliki energi yang berbeda dan, oleh karena itu, lapisan tersebut mulai digambarkan sebagai sublapisan (atau sublevel).
Untuk atom saat ini, setiap lapisan dapat didekomposisi menjadi empat sublevel, diwakili oleh huruf “s” (dari bahasa Inggris, tajam), “p” (dari bahasa Inggris, utama), “d” (dari bahasa Inggris, difusi) dan “f” (dari bahasa Inggris, mendasar).
Setiap sublevel mendukung jumlah elektron maksimum, yang ditentukan oleh perhitungan dan eksperimen. Sublevel “s” mendukung hingga 2 elektron; sublevel “p”, hingga 6 elektron; sublevel “d”, hingga 10 elektron; dan sublevel “f”, hingga 14 elektron. Lapisan K adalah satu-satunya yang hanya mengizinkan satu orbital dan, oleh karena itu, hanya memiliki satu sublevel.
Tingkat energi |
Lapisan |
Sublevel |
1 |
K |
1 detik |
2 |
L |
2s, 2p |
3 |
M |
3d, 3p, 3d |
4 |
N |
4d, 4p, 4d, 4f |
5 |
HAI |
5d, 5p, 5d, 5f |
6 |
P |
6d, 6p, 6d |
7 |
Q |
7 detik, 7 hal |
Fungsi elektrosfer
Elektrosfer setiap atom dapat digunakan untuk menjelaskan berbagai sifat dan perilaku atom.
Sifat-sifat seperti jari-jari atom, jari-jari ionik, energi ionisasi, dan afinitas elektron memiliki nilai yang merupakan akibat langsung dari konfigurasi elektronik elektrosfer, lebih khusus lagi disebut kulit valensi, yang sebenarnya merupakan kulit elektron terluar yang ditempati suatu atom atau ion.
A Kemiripan atom-atom dari golongan yang sama dalam Tabel Periodik juga merupakan konsekuensi dari konfigurasi elektron dari kulit valensi. Dalam proses kimia, kita memilih atom dari golongan yang sama pada Tabel Periodik sebanyak mungkin substituen, dan ini masuk akal, karena atom-atom ini memiliki konfigurasi elektronik yang sama pada lapisannya valensi.
Ke ikatan kimia, yang terjadi antar atom membentuk senyawa ionik dan kovalen (molekul), juga terjadi melalui interaksi antar elektrosfer atom.
Baca juga: Model atom Schrödinger — cara mendeskripsikan atom menggunakan mekanika kuantum
Hubungan antara elektrosfer dan struktur atom
Sebagaimana dicatat, elektrosfer mencakup wilayah atom tempat elektron dapat ditemukan. Elektron, lebih khusus lagi, terletak di orbital atom, yang memiliki energi yang ditentukan oleh perhitungan kuantum.
Elektrosfer adalah wilayah terbesar dalam struktur atom, karena inti atom sangat kecil. Jika kita menganggap atom sebagai stadion sepak bola, maka inti atom akan disamakan dengan sebuah bola di tengah lapangan, sedangkan bagian lain dari stadion akan menjadi elektrosfer.
Meskipun begitu, dalam hal massa, elektrosfer memberikan kontribusi yang kecil. Karena massa elektron sekitar 1.836 kali lebih kecil dibandingkan massa proton dan neutron, kita dapat mengatakan bahwa hampir seluruh massa atom terkonsentrasi di dalam inti.
Latihan terpecahkan di elektrosfer
pertanyaan 1
(Facisb 2023) Dalam model atom hidrogen Bohr, elektron hanya dapat menempati orbit tertentu. Beberapa dari orbit ini ditunjukkan pada gambar, dimana n mengacu pada tingkat energi yang dimiliki elektron di setiap orbit.
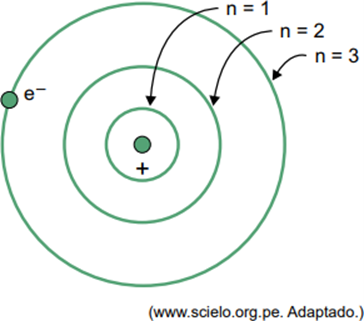
Misalkan, dalam atom hidrogen, elektron berada pada orbit dimana n = 5.
Menurut model Bohr, elektron ini hanya akan memancarkan energi dalam bentuk radiasi elektromagnetik
(A) melakukan transisi ke orbit di mana n sama dengan 6.
(B) tetap pada orbit dimana n = 5.
(C) transisi ke orbit mana pun yang n lebih besar dari 5.
(D) transisi ke orbit mana pun yang n kurang dari 5.
(E) dikeluarkan dari atom, mengionisasinya.
Jawaban: Huruf D
Ketika sebuah elektron berada di kulit terluar, setelah kembali ke kulit dalam yang energinya lebih rendah, ia melepaskan energi berlebih dalam bentuk radiasi elektromagnetik (cahaya). Oleh karena itu, terjadinya cahaya hanya akan terjadi ketika elektron yang ada pada n = 5 melakukan transisi ke kulit bagian dalam.
Pertanyaan 2
(Uerj 2019) Baru-baru ini, para ilmuwan berhasil menghasilkan hidrogen metalik dengan mengompresi molekul hidrogen di bawah tekanan tinggi. Sifat logam unsur ini sama dengan unsur lain pada golongan 1 tabel klasifikasi periodik.
Kesamaan ini terkait dengan sublevel paling energik dari elemen-elemen ini, yang berhubungan dengan:
(A) tidak1
(B) n.p.2
(C) tidak3
(D) nf4
Jawaban: Huruf A
Atom hidrogen hanya memiliki satu elektron, yang terletak di tingkat pertama, subtingkat “s” (1s1). Salah satu alasan mengapa unsur ini ditemukan pada golongan 1 Tabel Periodik adalah karena semua unsur kimia lain dalam golongan ini mempunyai atom yang kulit valensinya berjenis sama (ns1). Oleh karena itu, karena lapisan valensi yang serupa, hidrogen dapat diproduksi dalam bentuk logam ini.
Sumber:
LAKUKAN CANTO, E. L.; LEITE, L. L. W.; KANTO, L. W. Kimia – dalam kehidupan sehari-hari. 1. ed. Sao Paulo: Moderna, 2021.
ATKIN, P.; JONES, L.; LAVERMAN, L. Prinsip Kimia: Mempertanyakan kehidupan dan lingkungan. 7. ed. Porto Alegre: Bookman, 2018.
ATKIN, P.; DE PAULA, J.; KEELER, J. Kimia Fisika Atkins. edisi ke-11. Oxford: Pers Universitas Oxford, 2018.

