A hukum kedua termodinamika mendikte kondisi apa yang ada untuk panas diubah menjadi kerja dalam mesin kalor dan lemari es. Ini juga membahas definisi dari entropi sebagai fenomena yang mampu mengukur disorganisasi partikel dalam sistem fisik.
Baca juga: Kalorimetri — cabang fisika yang mempelajari pertukaran panas
Ringkasan hukum kedua termodinamika
Hukum kedua termodinamika diwakili oleh pernyataan Clausius dan Kelvin-Planck.
Pernyataan Clausius berkaitan dengan aliran panas dari benda yang lebih panas ke benda yang lebih dingin.
Pernyataan Kelvin-Planck membahas ketidakmampuan perangkat termal untuk mengubah semua panasnya menjadi bekerja.
Hukum kedua termodinamika diterapkan pada mesin panas dan lemari es.
Siklus Carnot adalah siklus efisiensi maksimum yang diperoleh oleh mesin kalor.
Siklus Carnot memiliki empat tahap, pemuaian isotermal reversibel, pemuaian adiabatik reversibel, pemampatan isotermal reversibel, dan pemampatan adiabatik reversibel.
Teorema Carnot mengacu pada hasil dari mesin Carnot.
Apa hukum kedua termodinamika?
Hukum kedua termodinamika adalah a hukum yang membahas kendala yang terjadi dalam proses termodinamika. Itu diucapkan oleh fisikawan Rudolf Clausius (1822-1888), Lord Kelvin (1824-1907) dan Max Planck (1858-1947), seperti yang akan kita lihat di bawah:
Fisikawan dan matematikawan Rudolf Clausius menyatakan bahwa aliran konduksi panas terjadi dari benda bersuhu lebih tinggi ke benda bersuhu lebih rendah. suhu yang lebih rendah, oleh karena itu, tidak wajar jika proses kebalikannya terjadi, oleh karena itu, perlu dilakukan pekerjaan pada ini sistem. Dengan itu, dia menyatakan:
Tidak mungkin melakukan proses yang efeknya hanya memindahkan panas dari benda yang lebih dingin ke benda yang lebih panas.|1|
Fisikawan matematika William Thomson, yang dikenal sebagai Lord Kelvin, bersama dengan kontribusi fisikawan Max Planck, menyatakan ketidakmungkinan perangkat termal memiliki efisiensi 100%, karena akan selalu ada kehilangan panas.
Aplikasi hukum kedua termodinamika
Hukum kedua termodinamika diterapkan pada mesin panas dan lemari es.
Hukum kedua termodinamika pada mesin panas
Ke Mesin termal mampu mengubah panas menjadi kerja. Sumber panas memasok panas ke mesin panas, yang mengubahnya menjadi kerja. Sisa panas yang dikirimnya ke sumber dingin, seperti digambarkan pada gambar di bawah ini:
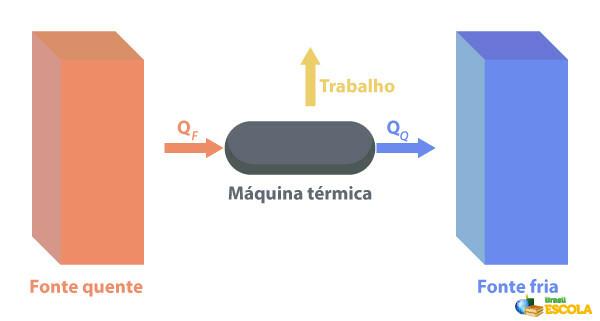
Beberapa contoh mesin termal adalah: turbin uap dan minyak tanah di pesawat jet, mesin pembakaran, reaktor termonuklir.
Hukum kedua termodinamika pada lemari es
Kulkas adalah mesin yang Mereka bekerja dengan cara yang berlawanan dengan memanaskan mesin., di mana mereka menghilangkan panas dari suatu daerah dengan suhu suhu yang lebih rendah dan memasoknya ke daerah dengan suhu yang lebih tinggi. Karena ini tidak alami, maka mesin perlu melakukan kerja dengan menggunakan energi listrik, seperti yang dijelaskan pada gambar di bawah ini:
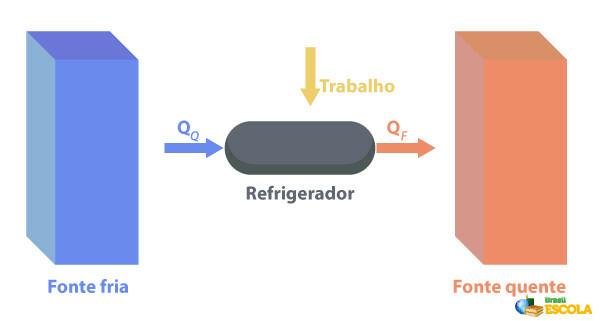
Beberapa contoh lemari es adalah lemari es dan AC.
Entropi dan hukum kedua termodinamika
A hukum kedua termodinamika mengusulkan keberadaan entropi, satu kuantitas fisik bertanggung jawab untuk mengukur tingkat disorganisasi partikel dalam sistem fisik atau tingkat ireversibilitas proses termodinamika yang terlibat dalam mesin panas, menjadi spontan, tak terhindarkan, tidak dapat diubah dan luas. Dengan ini, hanya mungkin untuk mengamati dan membatasi tingkat volatilitas proses. Ketika entropi meningkat, derajat ketidakteraturan dalam sistem juga meningkat.
A Nomenklatur entropi berasal dari bahasa Yunani dan berarti "transformasi"., "berubah", sehingga digunakan dalam Fisik untuk menunjukkan keacakan dan kekacauan. Entropi dapat dihitung dengan menggunakan rumus:
\(∆S=\frac{∆U}T\)
\(∆S\) adalah perubahan entropi, diukur dalam [J/K].
\(∆U\) adalah perubahan energi dalam, diukur dalam Joule [J].
T adalah suhu, diukur dalam Kelvin [K].
Dari sudut pandang statistik, entropi dihitung dengan rumus:
\(S=k\cdot ln\ Ω\)
S adalah entropi, diukur dalam [J/K].
k adalah konstanta Boltzmann, itu sangat berharga \(1,4\cdot 10^{-23}\ J/K\).
Ω adalah jumlah kemungkinan keadaan mikro untuk sistem.
Baca juga: Proses perambatan panas
Rumus hukum kedua termodinamika
Mesin termal dan lemari es
\(Q_Q=W+Q_F\)
\(Q_Q\) adalah panas sumber panas, diukur dalam Joule [J].
W adalah kerja yang dilakukan oleh mesin kalor, diukur dalam Joule [J].
\(Q_F\) adalah panas dari sumber dingin, diukur dalam Joule [J].
Itu dapat diwakili oleh:
\(W=Q_Q-Q_F\)
W adalah kerja yang dilakukan oleh mesin kalor, diukur dalam Joule [J].
\(Q_Q\) adalah panas sumber panas, diukur dalam Joule [J].
\(Q_F\) adalah panas dari sumber dingin, diukur dalam Joule [J].
Lemari es
\(η=\frac{Q_F}{Q_Q-Q_F}\)
\(η\) adalah efisiensi lemari es.
\(Q_F\) adalah panas dari sumber dingin, diukur dalam Joule [J].
\(Q_Q\) adalah panas sumber panas, diukur dalam Joule [J].
Itu dapat direpresentasikan sebagai:
\(η=\frac{Q_F}W\)
\(η\) adalah efisiensi lemari es.
\(Q_F\) adalah panas dari sumber dingin, diukur dalam Joule [J].
W adalah kerja yang dilakukan oleh mesin kalor, diukur dalam Joule [J].
Contoh penerapan formula
Contoh 1: Hitung usaha yang dilakukan mesin kalor selama siklus yang menerima 500 J kalor dari sumber panas dan hanya memindahkan 400 J kalor ke sumber dingin.
Untuk menghitung kerja mesin panas, kami akan menggunakan rumus:
\(W=Q_Q-Q_F\)
Mengganti nilai yang ditunjukkan dalam pernyataan:
\(W=500-400\)
\(W=100\ J\)
Pekerjaan mesin kalor adalah 100 Joule.
Contoh 2: Berapa efisiensi lemari es yang menerima 150 J kalor dari sumber panas dan memindahkan 50 J kalor ke sumber dingin?
Untuk menghitung efisiensi lemari es, kami akan menggunakan rumus:
\(η=\frac{Q_F}{Q_Q-Q_F}\)
Mengganti nilai yang diberikan dalam pernyataan, kami mendapatkan:
\(η=\frac{50}{150-50}\)
\(η=\frac{50}{100}\)
\(η=0,5\)
Mengalikan hasil dengan 100%:
\(η=0,5\cdot100%\)
\(η=50\%\)
Kulkas memiliki efisiensi 50%.
Siklus Carnot
Siklus Carnot adalah dikembangkan oleh ilmuwan Sadi Carnot (1796-1832), dengan tujuan untuk mengidentifikasi efisiensi maksimum yang dapat dicapai oleh mesin termal yang beroperasi antara sumber panas dan sumber dingin.
Berdasarkan studinya, Carnot mengidentifikasi bahwa, untuk mendapatkan efisiensi maksimum dari mesin panas, itu adalah diperlukan agar prosesnya dapat dibalik, jadi dia mengembangkan siklus hasil maksimum yang disebut siklus dari Carnot, dan Mesin panas yang bekerja melaluinya disebut mesin panas Carnot.. Karena siklus Carnot dapat dibalik, maka dapat dibalik, begitulah cara lemari es dikembangkan.
Siklus Carnot, terlepas dari zat yang digunakan, terdiri dari empat proses yang dijelaskan dalam grafik tekanan volume (p×V), seperti yang dapat kita lihat pada gambar di bawah ini:
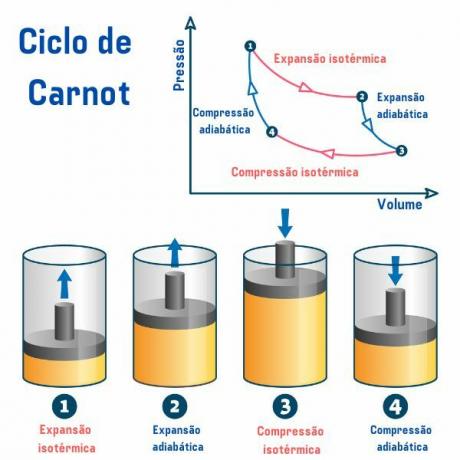
Proses 1, dari titik 1 → 2: ada ekspansi isotermal reversibel (proses di mana suhu tetap konstan), di mana gas (atau sistem) bekerja dan memperoleh sejumlah panas dari sumber panas.
Proses ke-2, dari titik 2 → 3: ada pemuaian adiabatik (proses di mana terjadi pertukaran panas dengan lingkungan luar) reversibel, di mana tidak ada pertukaran panas panas dengan sumber panas, tetapi gas melakukan kerja dan terjadi penurunan energi dalamnya sehingga menyebabkan penurunan suhu.
Proses ke-3, dari poin 3 → 4: terjadi kompresi isotermal reversibel, di mana gas menerima kerja dan melepaskan sejumlah panas ke sumber dingin.
Proses ke-4, dari poin 4 → 1: kompresi adibatik reversibel terjadi, di mana tidak terjadi pertukaran panas dengan sumber panas dan gas dipanaskan hingga mencapai suhu sumber panas, dan dengan demikian ditempatkan dalam kontak dengannya, mengakhiri siklus.
hukum termodinamika
Hukum termodinamika adalah empat hukum yang mengatur seluruh studi termodinamika, mempelajari hubungan antara volume, suhu dan tekanan dan kuantitas fisik lainnya, seperti panas dan energi.
Hukum ke nol termodinamika: adalah hukum dari keseimbangan termal, ia mempelajari pertukaran panas antara benda-benda yang memiliki suhu berbeda.
hukum pertama termodinamika: adalah hukum kekekalan energi dalam sistem termodinamika, yang mempelajari transformasi panas menjadi usaha dan/atau energi dalam.
Hukum kedua termodinamika: itu adalah hukum yang berhubungan dengan mesin panas, lemari es, dan entropi.
Hukum ketiga termodinamika: adalah hukum dari nol mutlak, dia mempelajari efek suhu ini.
Baca juga: Kinerja mesin panas
Latihan soal hukum kedua termodinamika
pertanyaan 1 Tentukan temperatur sumber panas sebuah mesin Carnot, diketahui temperatur sumber dinginnya 450 K dan efisiensinya 80%.
a) 2250K
b) 450K
c) 1500K
d) 900K
e) 3640 K
Resolusi:
Alternatif A. Kami akan menghitung suhu sumber panas berdasarkan rumus efisiensi mesin Carnot:
\(η=1-\frac{T_F}{T_Q} \)
\(80 \%=1-\frac{450}{T_Q} \)
\(\frac{80}{100}=1-\frac{450}{T_Q} \)
\(0,8=1-\frac{450}{T_Q} \)
\(0,8-1=-\frac{450}{T_Q} \)
\(-0,2=-\frac{450}{T_Q} \)
\(0,2=\frac{450}{T_Q} \)
\(T_Q=\frac{450}{0,2}\)
\(T_Q=2250\ K\)
pertanyaan 2 (Cefet-PR) Prinsip ke-2 termodinamika dapat dinyatakan sebagai berikut: “Tidak mungkin membuat mesin energi panas yang beroperasi dalam siklus, yang efek satu-satunya adalah menghilangkan panas dari sumber dan mengubahnya secara integral menjadi bekerja". Selanjutnya, prinsip ini membawa kita untuk menyimpulkan bahwa:
a) Selalu mungkin untuk membangun mesin termal yang efisiensinya 100%.
b) setiap mesin panas hanya membutuhkan satu sumber panas.
c) kalor dan kerja bukanlah besaran yang homogen.
d) setiap mesin panas menarik panas dari sumber panas dan membuang sebagian dari panas itu ke sumber dingin.
e) hanya dengan sumber dingin, selalu dipertahankan pada 0 °C, mesin kalor tertentu dapat mengubah kalor seluruhnya menjadi kerja.
Resolusi:
Alternatif D. Prinsip ini memberi tahu kita bahwa tidak mungkin membuang semua panas dari sumber panas dan memindahkannya ke sumber dingin.
Catatan
|1| Mata kuliah fisika dasar: Fluida, Osilasi dan Gelombang, Panas (vol. 2).
Oleh Pamella Raphaella Melo
Guru Fisika
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/fisica/segunda-lei-da-termodinamica.htm

