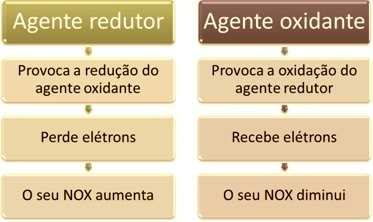
Salah satu ciri utama yang membedakan reaksi oksidasi-reduksi (atau redoks) lainnya adalah adanya zat pengoksidasi dan zat pereduksi, yang dapat didefinisikan sebagai berikut:
Misalnya, lihat reaksi kimia di bawah ini di mana aluminium (Al) terkorosi dalam larutan asam klorida (HCl) berair. Atom aluminium mentransfer elektron ke kation H+(sini) dan menghasilkan kation Al3+(sini):
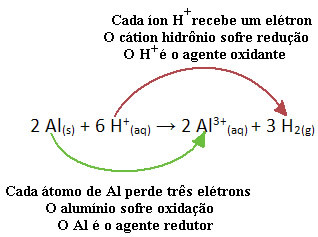
Perhatikan bahwa karena Al mentransfer elektron, ini berarti bahwa dia menyebabkan pengurangan dari kation H+(sini); makanya dia dipanggil agen pereduksi. Sudah menjadi kation H+(sini) melepaskan elektron dari aluminium, menyebabkan oksidasi dari logam itu; oleh karena itu ia bertindak sebagai agen pengoksidasi.
Dalam kehidupan sehari-hari, ada banyak contoh kinerja zat pengoksidasi dan zat pereduksi. Lihatlah beberapa dari mereka dan ingat, bagaimanapun, bahwa dalam semua kasus reduksi terjadi bersamaan dengan oksidasi; oleh karena itu, jika ada zat pereduksi, ada juga zat pengoksidasi.
- Contoh zat pereduksi:
- Dalam film fotografi: film fotografi mengandung garam perak peka cahaya. Pada titik-titik di mana ada insiden cahaya, ada pengurangan ion Ag Ag+, sehingga kontras diamati dalam negatif.

- Vitamin C: Vitamin C (asam L-askorbat) adalah zat pereduksi yang kuat dalam larutan berair. Ini memiliki fasilitas luar biasa untuk dioksidasi dan itulah sebabnya ia banyak digunakan, terutama dalam makanan seperti: antioksidan, yaitu, ditambahkan ke makanan lain dan melindunginya dari kemungkinan oksidasi, karena sifatnya sendiri pengorbanan. Contohnya adalah buah-buahan seperti apel dan pir yang menjadi gelap jika bersentuhan dengan oksigen di udara, karena teroksidasi. Tetapi ketika Anda menambahkan sedikit jus jeruk atau lemon (yang mengandung vitamin C) ke dalam buah dipotong, ini mencegah reaksi ini terjadi, karena vitamin C bertindak sebagai zat pereduksi dan mengoksidasi sebelum buah.

- Gas hidrogen: gas hidrogen (H2) digunakan dalam propulsi roket dan dianggap sebagai salah satu alternatif energi yang paling penting, karena pembakarannya melepaskan sejumlah besar energi dan tidak ada polutan. Dalam reaksi ini, hidrogen bertindak sebagai zat pereduksi, dioksidasi oleh oksigen.
- Contoh oksidator:
- Dalam produksi cuka: ketika anggur terkena udara, itu berubah menjadi cuka, yang komponen utamanya adalah asam asetat. Ini karena etil alkohol atau etanol yang ada dalam anggur teroksidasi saat bersentuhan dengan oksigen atmosfer, menghasilkan asam asetat. Dengan demikian, oksigen adalah agen pengoksidasi. Bahkan asal usul istilah "oksidasi" terkait dengan reaksi dengan oksigen.

- Dalam karat: seperti yang dinyatakan dalam contoh sebelumnya, oksigen bertindak sebagai zat pengoksidasi untuk alkohol; dan hal ini juga terjadi dalam kontak dengan berbagai logam, seperti besi, yang menyebabkan proses karat. Selain oksigen di udara, zat pengoksidasi lain dalam hal ini adalah air atau larutan asam.
- Dalam pemutih: efek pemutihan dari pemutih adalah karena adanya dua agen pereduksi berikut: o anion hipoklorit (umumnya dalam bentuk garam natrium – NaOCl), terdapat, misalnya, dalam pemutih; dan hidrogen peroksida (H2HAI2), dipasarkan sebagai hidrogen peroksida. Kedua senyawa ini memiliki kecenderungan yang sangat kuat untuk mengoksidasi dan menyebabkan reduksi spesies kimia lainnya. Oleh karena itu, mereka bertanggung jawab untuk mengoksidasi zat yang memberikan warna gelap pada produk. Misalnya, dalam selulosa, lignin dipecah dan menjadi lebih ringan dan lebih lunak. Dalam kasus penghilangan noda dan pemutihan kain, zat pengoksidasi ini menyebabkan oksidasi molekul organik seperti lemak dan pewarna.

- Dalam breathalyzer: alat penghisap udara sekali pakai sederhana terdiri dari tabung bening yang berisi larutan berair garam dikromat kalium dan silika, yang dibasahi dengan asam sulfat; bercampur dengan warna orange. Garam ini, dalam kontak dengan uap alkohol yang terkandung dalam napas pengemudi mabuk, bereaksi, mengubah warna menjadi hijau. Ini berarti terjadi oksidasi etanol (alkohol) menjadi etanal.

Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/conceito-exemplos-agente-redutor-agente-oxidante.htm


