ionisasi adalah fenomena kimia di mana zat asam (yang rumus umumnya adalah HX), ketika dilarutkan dalam air, menimbulkan dua ion: kation hidronium (H3HAI+ atau H+) dan setiap anion (X-). Fenomena tersebut direpresentasikan dari sebuah persamaan. Lihat:
HX + H2O → H3HAI+ + X-
Selama ionisasi, hanya hidrogen yang dapat terionisasi dari AC id mereka diubah menjadi kation hidronium, faktor yang juga bergantung pada kapasitas ionisasi asam ini, yaitu pada derajat ionisasi (α). Jadi, tidak semua hidrogen membentuk hidronium, kecuali asam memiliki derajat ionisasi sama dengan 100%.
Namun, ketika kita membangun persamaan ionisasi, kita tidak memperhitungkan derajat ionisasi asam, tetapi jumlah hidrogen yang dapat terionisasi yang dia hadirkan.
Sebagai aturan, kami menganggap hidrogen yang dapat terionisasi sebagai semua hidrogen yang ada dalam hydracid. Dalam kasus asam oksi, hanya hidrogen yang terikat pada atom karbon yang dapat terionisasi, seperti yang dapat dilihat dalam rumus struktur yang ditunjukkan di bawah ini:
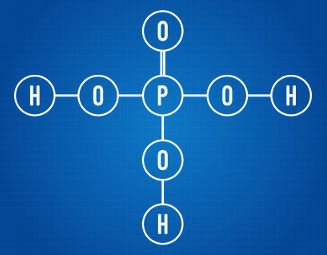
Asam fosfat memiliki tiga hidrogen yang dapat terionisasi
Menganalisis rumus struktur di atas, kita dapat melihat bahwa asam yang dimaksud memiliki tiga atom hidrogen yang terikat pada atom oksigen. Dengan demikian, ia memiliki total tiga hidrogen yang dapat terionisasi.
Lihat beberapa contoh perakitan persamaan ionisasi beberapa asam:
Contoh 1: Asam Hidrobromat (HBr)
HBr + H2O → H3HAI+ + Br-
Asam hidrobromat adalah hidrat dengan hanya satu hidrogen dalam komposisinya. Karena semua hidrogen dalam hidrat dapat terionisasi, ia hanya terbentuk ketika dilarutkan dalam air satu mol kation hidronium ini adalah anion bromida (Br-).
Contoh 2: Hidrogen sulfida (H2S)
H2Y+ 2 H2O → 2 H+ + S-2
Hidrogen sulfida adalah hydracid dengan dua hidrogen dalam komposisinya. Karena semua hidrogen dalam asam hidrat dapat terionisasi, ketika dilarutkan dalam air, ia membentuk, dua mol kation hidronium ini adalah anion sulfida (S-2). Untuk ini, kami menggunakan dua mol air.
Contoh 3: asam mangan (H2MnO4)
H2MnO4 + 2 H2O → 2 H3HAI+ + MnO4-2
Asam mangan adalah asam oksi dengan dua hidrogen dalam komposisinya. Seperti dalam asam oksi, hanya hidrogen yang terikat pada oksigen yang dapat terionisasi – dalam kasus asam mangan, kedua hidrogen tersebut –, akan terbentuk, ketika larut dalam air, dua mol kation hidronium ini adalah anion manganat (MnO4-2). Untuk ini, kami menggunakan dua mol air.
Contoh 4: Asam Fosfor (H3DEBU3)
H3DEBU3 + 2 H2O → 2 H3HAI+ + HPO3-2
Asam fosfat adalah asam oksi dengan tiga hidrogen dalam komposisinya. Seperti dalam asam oksi hanya hidrogen yang terikat pada oksigen yang dapat terionisasi – dalam kasus asam fosfat, kedua hidrogen tersebut –, akan terbentuk, ketika dilarutkan dalam air, dua mol kation hidronium ini adalah anion fosfit (HPO3-2). Untuk ini, kami menggunakan dua mol air.
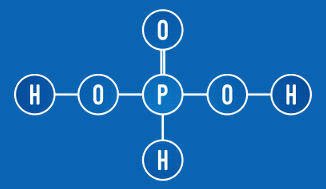
Asam fosfat memiliki dua hidrogen yang dapat terionisasi (gugus OH)
Contoh 5: Asam borat (H3BO3)
H3BO3 + 3 H2O → 3 H+ + BO3-3
Asam borat adalah asam oksi dengan tiga hidrogen dalam komposisinya. Seperti dalam asam oksi, hanya hidrogen yang terikat pada oksigen yang dapat terionisasi – dalam kasus asam borat, ketiga hidrogennya adalah –, ia akan terbentuk, ketika dilarutkan dalam air, tiga mol kation hidronium ini adalah anion borat (BO3-3). Untuk ini, kami menggunakan tiga mol air.
Contoh 6: Asam pirofosfat (H4P2HAI7)
H4P2HAI7 + 4 H2O → 4 H3HAI+ + P2HAI7-4
Asam pirofosfat adalah asam oksi dengan empat hidrogen dalam komposisinya. Seperti dalam asam oksi hanya hidrogen yang terikat pada oksigen yang dapat terionisasi – dalam kasus asam borat, keempat hidrogennya adalah –, ia akan terbentuk, ketika dilarutkan dalam air, empat mol kation hidronium ini adalah anionpirofosfat (P2HAI7-4). Untuk ini, kami menggunakan empat mol air.
Oleh Saya Diogo Lopes Dias
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/equacoes-ionizacao-dos-acidos.htm


