Oksida asam adalah oksida yang bila bereaksi dengan air menghasilkan asam sebagai produk. Ketika bereaksi dengan basa, produknya akan menjadi garam dan air.
Senyawa-senyawa ini biasanya bersifat kovalen, yaitu bersifat molekuler, larut dalam air dan sebagian besar dibentuk oleh nonlogam, yaitu unsur-unsur dengan keelektronegatifan tinggi. Ketika dibentuk oleh logam, ini memiliki bilangan oksidasi tinggi (muatan listrik).
Contoh:
BERSAMA2, HANYA2, HANYA3, P2HAI5, Cl2HAI6, PADA2, tidak2HAI4, tidak2HAI5, dll.
Berikut ini adalah skema umum reaksi karakteristik untuk oksida asam dan contohnya:
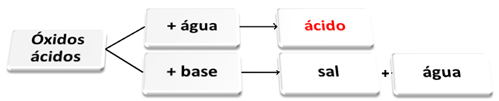
Oksida asam bereaksi dengan air dan dengan basa
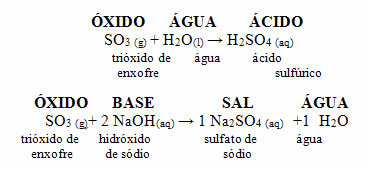
Oksida asam disebut juga anhidrida, karena kata ini berasal dari bahasa Yunani anhydros, yang berarti "tidak ada air", dan oksida asam dapat dianggap sebagai "asam tanpa air".
Sifat dan aplikasi beberapa oksida asam:
• Karbon dioksida (karbon dioksida) - CO2:
Senyawa ini digunakan sebagai gas dalam minuman ringan dan air mineral, karena jika diberi tekanan tinggi akan larut dalam air. Ini menghasilkan dalam produk ini media asam, karena merupakan oksida asam yang bereaksi dengan air, menghasilkan asam, sesuai reaksi di bawah ini:

Di bawah 78°C, ia dalam keadaan padat dan dikenal sebagai es kering, yang mendapatkan namanya karena penampilannya yang menyerupai es. umum, tetapi tidak meleleh, beralih ke keadaan cair pada suhu kamar, tetapi ia pergi ke keadaan uap, yaitu, luhur. Dengan demikian, fitur ini digunakan sebagai sumber pemandangan di konser, film, teater, pesta, dll.

Karbon dioksida adalah oksida asam
Hal ini juga ditemukan di atmosfer sebagai hasil dari respirasi manusia, pembakaran bahan bakar fosil (batubara, produk minyak bumi, alkohol, dll) dan kebakaran hutan. Dengan demikian, dia adalah salah satu yang bertanggung jawab atas hujan asam.
• Sulfur oksida - SO2 dan sebagainya3
Oksida-oksida ini juga ada di atmosfer, yang berasal dari alam dan buatan. Alam terjadi melalui letusan gunung berapi dan dekomposisi tumbuhan dan hewan. Buatan sesuai dengan jumlah terbesar dari oksida ini di atmosfer, sebagaimana adanya dikeluarkan dengan membakar bahan bakar fosil, terutama minyak solar, yang mengandung belerang seperti: ketidakmurnian.
Sulfur dioksida (SO2) bereaksi dengan oksigen dari atmosfer menghasilkan belerang trioksida (SO3). Ketika oksida terakhir ini bereaksi dengan air hujan, asam sulfat terbentuk, yang sangat kuat dan menyebabkan kerusakan.
• Pembakaran belerang dari bahan bakar: S + O2 → OS2
• Transformasi SO2 menjadi SO3: SO2 +2 → OS3
Reaksi SO2 dan SO3 dengan air menghasilkan asam: SO2 + H2O → H2HANYA3
HANYA3 + H2O → H2HANYA4
• Dinitrogen tetroksida (nitrous-nitric anhydride) - N2HAI4
Senyawa ini memiliki titik didih 22ºC, berwarna kuning dan cukup mudah menguap. Ini terbentuk di atmosfer oleh oksidasi nitrogen dan bisa dalam bentuk cair, dalam bentuk dimer mononitrogen dioksida atau oksida nitrat (NO2). Di atas suhu itu, ia mengambil bentuk NO2:
tidak2HAI4 TIDAK2
Ini adalah gas yang sangat beracun dan penghirupannya berakibat fatal. Ini juga digunakan dalam komposisi bahan bakar roket.
Oleh Jennifer Fogaa
Lulus kimia

