ITU nihonium, nomor atom 113 dan lambang Nh, adalah unsur kimia yang termasuk golongan 13 dari Tabel Periodik. Selain itu, ini adalah elemen super berat yang tidak ditemukan di alam. Dengan demikian, perolehannya hanya dapat dilakukan secara artifisial, melalui reaksi fusi nuklir. Karakteristik kimia dari nihonium masih belum begitu jelas, tetapi diperkirakan bahwa ia berperilaku serupa dengan rekan yang lebih ringan, thallium, dalam beberapa kasus.
Nihonium awalnya diperoleh dengan melelehkan 70Zn dengan 209Bi, di Riken Institute, Jepang, pada tahun 2003. Meskipun ilmuwan Rusia dan Amerika juga meminta untuk diakui sebagai penemu unsur 113, IUPAC mengakui para ilmuwan Jepang. Nama tersebut mengacu pada kata Nihon, sebagaimana orang Jepang menyebut negara asal mereka.
Baca juga: Gallium — unsur kimia lain yang termasuk golongan 13 dari Tabel Periodik
ringkasan tentang nihonium
Ini adalah elemen kimia sintetis yang terletak di grup 13 dari Tabel periodik.
Produksinya dimulai pada tahun 2003, di Riken Institute, Jepang.
Itu membuat kelompok elemen yang terakhir dimasukkan dalam Tabel Periodik, pada tahun 2015.
Studinya masih sangat baru, tetapi beberapa berusaha menghubungkannya dengan elemen lain dari kelompok 13, seperti talium.
Produksinya adalah Fusi nuklir, menggunakan isotop 70Zn dan atom dari 209Dua.
Sifat Nihonium
Simbol: tidak
Nomor atom: 113
Massa atom: antara 278 dan 286 c.u. (tidak resmi oleh Iupac)
Konfigurasi elektronik: [Rn] 7s2 5f14 6d10 7p1
Isotop paling stabil:286Nh (9,5 detik dari setengah hidup, yang dapat meningkat sebesar 6,3 detik atau berkurang sebesar 2,7 detik)
seri kimia: grup 13, elemen super berat
ciri-ciri nihonium
Nihonium, simbol Nh dan nomor atom 113, adalah salah satu elemen terakhir yang termasuk dalam Tabel Periodik. Peresmiannya dilakukan pada 30 Desember 2015, oleh International Union of Pure and Applied Chemistry (IUPAC), sedangkan namanya baru diresmikan pada pertengahan 2016.
Unsur-unsur di wilayah Tabel Periodik ini sangat tidak stabil, artinya mereka tidak dapat ditemukan di alam. Jadi, dalam menghadapi dugaan keberadaan, mereka akan mengalami peluruhan radioaktif hampir seketika — emisi partikel nuklir, seperti dan — untuk mencapai stabilitas yang lebih besar.
Namun, ketika mereka memancarkan partikel nuklir, mereka akhirnya mengalami transmutasi nuklir, yaitu, mereka menjadi unsur kimia baru. Jadi, elemen superberat, seperti Nh, harus diproduksi di laboratorium, yang membuatnya menjadi a unsur kimia sintetis.
Nh, seperti elemen superberat lainnya, dipengaruhi oleh efek relativistik — secara sederhana, jarak dari apa yang diamati dengan apa yang diharapkan, karena relativitas. Jadi, studi matematika di bidang teoretis, yang mensimulasikan konsekuensi dari efek relativistik, menunjukkan bahwa nihonium bisa berinteraksi lemah dengan kuarsa, tapi memiliki adsorpsi yang baik untuk emas, seperti pasangannya yang lebih ringan, talium (Tl).
Studi teoritis awal juga menunjukkan keriangan dari Nh. Adapun adsorpsi ke kuarsa, talium mudah membentuk TlOH, misalnya, dan nihonium diduga melakukan hal yang sama.
Meski begitu, bagaimana studi masih sangat awal dan baru-baru ini, banyak dari apa yang telah dihasilkan terbuka untuk diskusi, dan sulit untuk secara akurat menentukan sifat fisikokimia nihonium.
Mendapatkan Nihonium
Elemen 113, hingga saat ini, diperoleh dengan dua cara: melalui reaksi fusi dingin, dengan peleburan seng (Zn, Z = 30) dengan bismut (Bi, Z = 83), dan juga melalui peluruhan alfa elemen 115.
Pada contoh pertama, seng dipercepat menjadi 10% dari kecepatan cahaya, untuk mengatasi gaya tolak menolak kedua inti. Isotop kemudian diproduksi 279Nh, yang akhirnya memancarkan neutron dan menghasilkan 278Nh.

Dengan waktu paruh sekitar 34 milidetik, isotop 278Nh mengalami enam peluruhan alfa (emisi partikel alfa) menjadi elemen mendelevium (Md).
Dalam kasus kedua, elemen 113 muncul dari peluruhan alfa elemen 115 (sekarang dikenal sebagai muscovium) setelah disintesis. Salah satu caranya adalah reaksi fusi panas ion 48Ca dengan isotop 243ah, memproduksi 288Mc dan kemudian, dengan peluruhan alfa, 284Nh, yang terus mengalami peluruhan alfa.
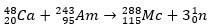
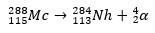
Lihat juga: Hassium — unsur kimia sintetik terberat untuk dianalisis sifat-sifatnya
sejarah nihonium
Pencarian untuk elemen 113 dimulai pada tahun 2003. Peneliti Jepang di Riken Institute mempercepat isotop 70Zn pada 10% dari kecepatan cahaya untuk bertabrakan dengan 209Bi, melalui reaksi fusi. Dengan demikian, mereka berhasil menghasilkan apa yang sekarang kita kenal sebagai 278Nh.
Namun, baru pada tahun 2012 Peneliti Jepang mampu mendeteksi seri peluruhan alfa lengkap unsur 113, menghubungi IUPAC untuk mengklaim penemuan tersebut.
Bersamaan dengan upaya Jepang, ilmuwan Rusia yang dipimpin oleh Yuri Oganessian, bekerja sama dengan Ilmuwan Amerika, juga datang untuk mengidentifikasi unsur 113 melalui peluruhan alfa dari unsur tersebut 115. Eksperimen semacam itu juga menempatkan ilmuwan Rusia dan Amerika dalam persaingan untuk pengakuan elemen 113.

Namun, IUPAC menemukan bukti dari institut Riken lebih kuat, sehingga memungkinkan Jepang untuk memiliki hak untuk menyebutkan elemen 113. Nama yang dipilih adalah nihônio, simbol Nh, mengacu pada negara Jepang. Kata Jepang ditulis oleh orang Jepang menggunakan dua huruf Cina yang berarti “negeri matahari terbit” dan dibaca sebagai Nihon atau Nippon.
Nama nihonium juga dipilih karena, pada tahun 1908, ahli kimia Jepang Masataka Ogawa menerbitkannya telah menemukan elemen 43, menamakannya Jepang, simbol Np (yang hari ini milik neptunium, Z = 93). Namun, belakangan terbukti bahwa unsur 43 tidak stabil, tidak ditemukan di alam dan baru disintesis pada tahun 1937, diberi nama teknesium (Tc).
Dengan demikian, Jepang menghilang dari Tabel Periodik. Namun, bertahun-tahun kemudian, terbukti bahwa, pada kenyataannya, Ogawa telah menemukan elemen 75 (sekarang dikenal sebagai renium). Namun, pada saat itu, unsur renium telah secara resmi ditemukan pada tahun 1925 dan dibaptis.
Latihan yang diselesaikan tentang nihonium
pertanyaan 1
Nihonium, simbol Nh dan nomor atom 113, adalah unsur kimia yang tidak dapat ditemukan di alam karena waktu paruhnya yang pendek. Yang paling tahan lama dari mereka, 286Nh, memiliki sekitar 9,5 detik. Mengetahui bahwa waktu paruh adalah waktu yang diperlukan untuk jumlah spesies berkurang setengahnya, berapa detik yang diperlukan untuk jumlah isotop di atas menjadi 1/16 dari jumlah awal?
A) 9.5
B) 19
C) 28.5
D) 38
E) 47,5
Resolusi:
Alternatif D
Setiap 9,5 detik, jumlah isotop turun setengahnya. Jadi, setelah 9,5 detik, jumlahnya menjadi setengah dari jumlah awal. 9,5 detik lagi, total 19 detik, jumlahnya turun setengah lagi, mencapai 1/4 dari awal.
Pada 28,5 detik, setelah waktu paruh lagi, jumlahnya turun setengah lagi, mencapai 1/8 dari jumlah awal. Akhirnya, setelah 38 detik, jumlahnya turun setengah lagi, mencapai 1/16 dari jumlah awal, seperti yang diminta dalam pernyataan. Jadi, waktu yang dibutuhkan adalah 38 detik.
pertanyaan 2
Pada tahun 2003, pencarian elemen 113 dimulai di Riken Institute di Jepang. Pada saat itu, para ilmuwan mampu menghasilkan 278Nh melalui peleburan atom seng dan bismut.
Berapa banyak neutron dalam isotop yang dikutip?
A) 113
B) 278
C) 391
D) 170
E) 165
Resolusi:
Alternatif E
Jumlah neutron dapat dihitung sebagai:
A = Z + n
dimana A adalah banyaknya Semacam spageti atom, Z adalah nomor atom dan n adalah jumlah neutron. Mengganti nilai, kami memiliki:
278 = 113 + n
n = 278 - 113
n = 165
Oleh Stefano Araújo Novais
guru kimia

