Molekul zat tidak semuanya lurus, seolah-olah berada dalam satu bidang. Bagaimanapun, mereka tersebar di ruang angkasa dan atom-atomnya mengambil pengaturan atau pengaturan yang berbeda. Dengan demikian, ada bentuk geometris yang berbeda untuk molekul setiap jenis zat.
Salah satu cara paling sederhana untuk menentukan geometri molekul didasarkan pada teori tolakan pasangan elektron kulit valensi (RPECV). Menurut teori ini, pasangan elektron dari atom pusat berfungsi sebagai: awan elektronik yang saling tolak. Dengan cara ini, mereka berorientasi sejauh mungkin satu sama lain. Geometri molekul akan tergantung pada jumlah pasangan elektron di sekitar atom pusat.
Awan elektronik ini dapat terdiri dari elektron yang berpartisipasi dalam ikatan (tunggal, ganda atau rangkap tiga) dan juga yang tidak berpartisipasi. Jadi kita punya:
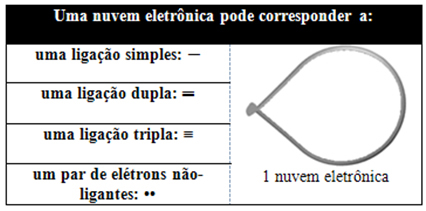
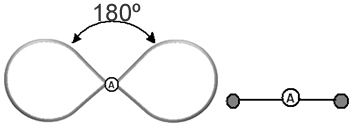
Ini membantu untuk memikirkan awan ini sebagai balon atau balon yang ditambatkan, dengan atom pusat di tengahnya. Misalnya, dalam molekul yang hanya memiliki dua awan elektron di sekitar atom pusat, semakin besar jarak yang mungkin antara mereka adalah sudut 180º dan, akibatnya, geometri molekul akan menjadi linier.
Oleh karena itu, kita dapat membuat kesimpulan tentang seperti apa geometri molekul sebagian besar molekul jika kita memperhitungkan jumlah atom dalam molekul, dan ikatan yang dibuat oleh atom pusat, memeriksa apakah ia memiliki pasangan atau tidak elektron.
Lihat contoh di bawah ini:
- Molekul dengan 2 atom: akan selalu linier
Sebagai contoh:
H H, H Cl, F F, O O, C O.
- molekul 3-atom: sudut atau segitiga
jika atom pusat memiliki sepasang elektron yang tidak mengikat geometrinya menjadi sudut, seperti dalam kasus molekul SO2:
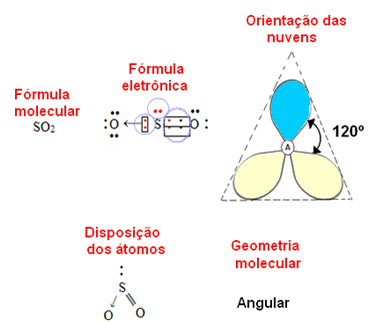
Pertimbangkan awan elektron biru untuk mewakili pasangan elektron yang tidak berpartisipasi dalam ikatan, dan awan kuning sebagai pasangan elektron yang berpartisipasi dalam ikatan.
- molekul 4 atom: pesawat trigonal (atau segitiga) atau piramida (atau piramida trigonal)
Jika atom pusat tidak memiliki pasangan elektron tidak berpasangan (non-ikatan), geometri molekulnya adalah segitiga datar (atau segitiga). Lihat contoh BF3:

Jika atom memiliki pasangan elektron yang tidak mengikat, geometri molekul akan menjadi piramidal (atau piramida trigonal), seperti dalam kasus amonia:

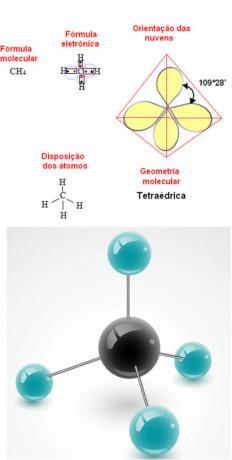
- molekul 5-atom: tetrahedral
Contoh Geometri Metana:
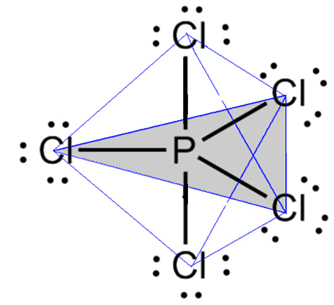
- Molekul dengan 6 atom: trigonal bipyramid atau piramida segitiga.
Contohnya adalah fosfor pentaklorida (PCl5), yang memiliki beberapa hubungan antara fosfor dan klorin pada sudut 90º dan lainnya 120º, membentuk bipiramid dengan alas segitiga:
- molekul 7-atom: bersegi delapan
Contoh: belerang heksafluorida (SF6), yang sudutnya 90º.

Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/determinacao-geometria-das-moleculas.htm