Distribusi elektronik mengacu pada bagaimana elektron didistribusikan di lapisan atau tingkat energi yang mengelilingi inti atom.
Menurut model atom Rutherford-Böhr, atom-atom dari unsur kimia yang diketahui memiliki paling banyak tujuh lapisan elektronik, yang meningkatkan energi dari dalam ke luar inti (1 – 2 – 3 – 4 – 5 – 6 – 7). Ketujuh lapisan ini juga dapat ditandai dengan huruf masing-masing K – L – M – N – O – P – Q, dengan K menjadi yang pertama, lebih dekat ke inti dan memiliki energi paling rendah. Di sisi lain, lapisan Q adalah yang ketujuh, yang terjauh dari inti dan yang memiliki energi tertinggi.
Karena setiap atom memiliki nomor atom (jumlah proton dalam inti) dan jumlah elektron yang berbeda, maka lapisan elektron dari setiap atom memiliki energi berbeda yang menahan elektron dengan energi itu ditentukan.
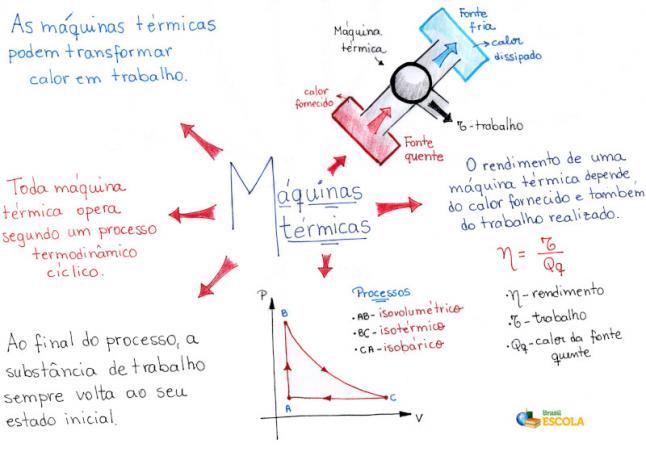
Peta Pikiran: Distribusi Elektronik

* Untuk mengunduh peta pikiran dalam PDF, Klik disini!
Perhatikan di bawah ini beberapa atom dan elektron yang terdistribusi dalam lapisan elektroniknya:

Atom hidrogen, helium, berilium, dan oksigen
Perhatikan bahwa distribusi empat atom berilium adalah: 2 – 2, dan oksigen adalah 2 – 6. Hanya melalui contoh-contoh ini adalah mungkin untuk melihat bahwa distribusi elektronik mengikuti suatu perintah. Misalnya, kulit K (1) dapat memiliki maksimal dua elektron.
Di bawah ini kami memiliki tabel yang menentukan jumlah maksimum elektron yang dapat didistribusikan di setiap lapisan elektronik:

Jumlah maksimum elektron dalam level elektronik
Juga harus diingat bahwa kulit terakhir yang harus diisi, yang disebut kulit valensi, harus memiliki maksimal delapan elektron. Jadi jika Anda mendistribusikan elektron dan melihat bahwa kulit terakhir memiliki kuantitas lebih besar dari 8, tetapi lebih kecil bahwa 18, maka, hanya menyisakan 8 elektron di kulit itu dan menambahkan sisanya di kulit berikutnya plus luar.
Sebagai contoh, perhatikan distribusi elektron atom kalsium. Melihat tabel periodik, kita melihat bahwa ia memiliki nomor atom sama dengan 20, sedangkan pada keadaan dasar, ada jumlah elektron yang sama. Jadi, kita harus mendistribusikan 20 elektron di kulit elektronnya. Lihat di bawah ini:

Distribusi elektronik kalsium dalam atom
Perhatikan bahwa kulit M dapat menampung hingga 18 elektron, tetapi jika kita menempatkan elektron yang tersisa di dalamnya, itu akan memiliki 10 elektron, yang tidak dapat terjadi di kulit valensi. Jadi kami menempatkan elektron lainnya (2) di kulit berikutnya, yaitu N.
Tetapi jika jumlah elektron di kulit terakhir antara 18 dan 32, Anda meninggalkan 18 elektron dan meneruskan sisanya ke kulit terluar. Lihat contoh lain:

Distribusi elektronik barium dalam atom
Perhatikan bahwa kulit “N” dapat berisi maksimum 32 elektron, tetapi di sini akan memiliki 28. Jadi kami meninggalkan 18 elektron dan meneruskan sisanya ke kulit berikutnya. Tapi kulit "O" akan memiliki 10 elektron, jadi kami meninggalkan 8 dan mendistribusikan 2 elektron yang tersisa ke kulit "P".
Namun, ada cara yang lebih mudah untuk melakukan distribusi elektron elektron atom ini. Itu melalui diagram pauling (karena diciptakan oleh ilmuwan Linus Carl Pauling (1901-1994)), juga dikenal sebagai diagram distribusi elektronik atau belum, Diagram tingkat energi. Diagram ini terlihat seperti ini:

Representasi grafis dari distribusi elektronik diberikan oleh Diagram Pauling
Untuk memahami bagaimana distribusi elektron dan ion dibuat dalam diagram ini, baca teks di bawah ini:
* distribusi elektron;
* distribusi ion elektronik.
* Kredit gambar dari Linus Pauling: Hadiah Nobel.org
** Peta Pikiran oleh Saya. Diogo Lopes
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-distribuicao-eletronica.htm