Molekul adalah kumpulan atom, sama atau berbeda, bergabung dengan ikatan kovalen.
Spesies kimia ini secara elektrik netral dan mewakili unit pembentuk suatu zat.
Ada molekul sederhana seperti oksigen (O2) dari udara yang kita hirup. Namun, ada juga senyawa kompleks, seperti bola bucky (60 atom karbon terikat dalam bentuk bola), yang merupakan molekul terbesar yang pernah ditemukan di ruang angkasa.
Studi Molekul
Ikatan kovalen dalam suatu molekul berhubungan dengan berbagi elektron, biasanya antara unsur-unsur non-logam.
Lihat molekul air sebagai contoh senyawa sederhana.
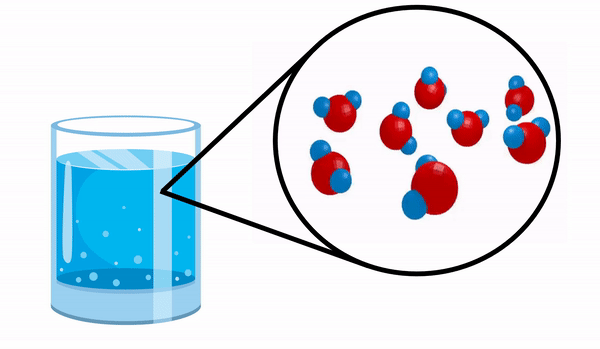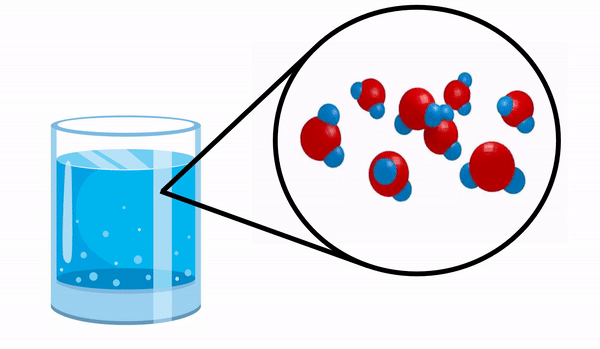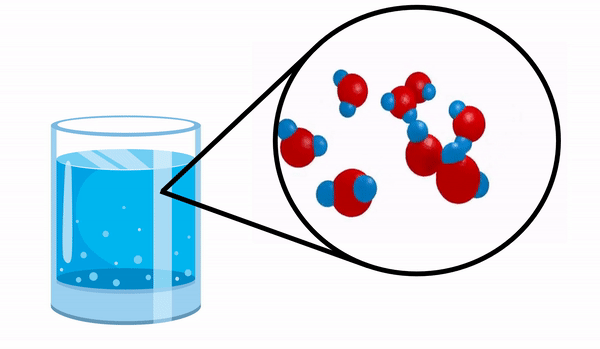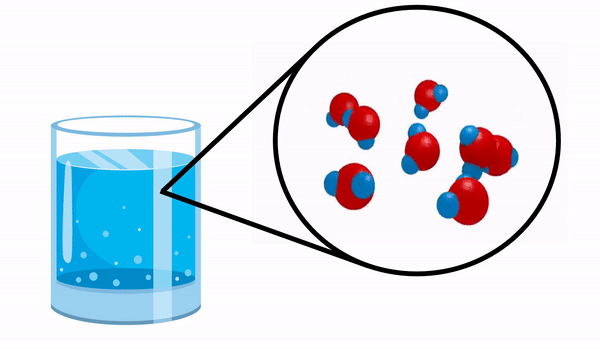
Ketika kita mengamati gelas dengan air kita tidak tahu bahwa zat ini terdiri dari beberapa molekul H2HAI. Rumus ini menunjukkan bahwa air terdiri dari 3 atom: dua atom hidrogen dan satu atom oksigen, yang saling berbagi elektron.
Gula, yang kita gunakan untuk mempermanis jus dan membuat kue, juga terdiri dari molekul. Satuan pembentuk gula adalah sukrosa.

Molekul ini jauh lebih kompleks, karena ada 45
atom terhubung. Ini dibentuk oleh: 12 atom karbon, 22 atom hidrogen dan 11 atom oksigen.Molekul adalah struktur massa molekul yang diketahui, tetapi ada juga makromolekul, yang merupakan "struktur raksasa" yang dibentuk oleh begitu banyak atom sehingga komposisinya bahkan tidak terdefinisi. Contoh dari jenis ini adalah berlian, makromolekul yang dibentuk oleh banyak atom dari karbon dalam jaringan kovalen.
Ikatan kovalen
Ikatan kimia kovalen terbentuk antara dua atom ketika mereka berbagi elektron lebih eksternal (valensi). Molekul dapat memiliki dua jenis ikatan:
Ikatan kovalen molekul: pasangan elektron dari dua atom ikatan digunakan bersama.

Ikatan Kovalen Kovalen (datif): elektron bersama berasal dari hanya satu atom yang terlibat.
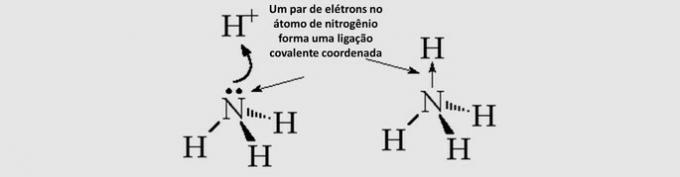
Geometri Molekuler
Ketika sebuah molekul terbentuk, atom-atom diposisikan dengan cara yang berbeda, sehingga pengaturan spasial lebih stabil. Oleh karena itu, komposit memiliki geometri yang berbeda.
Berikut adalah beberapa geometri yang dapat dimiliki molekul.
| Geometri Molekuler | ||
|---|---|---|
| Linier | sudut | segitiga |
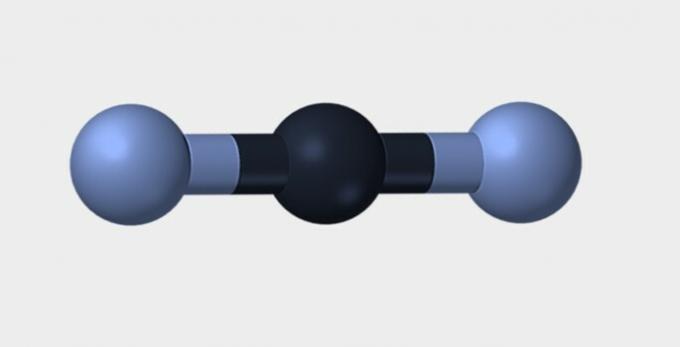 |
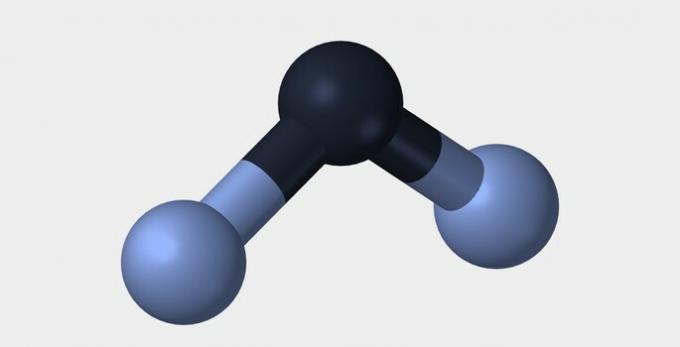 |
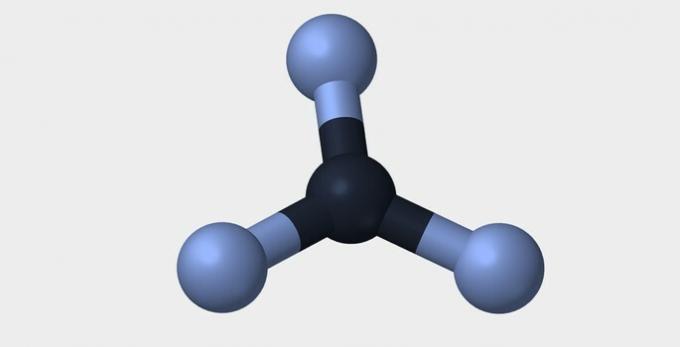 |
| Berbentuk piramide | tetrahedral | bersegi delapan |
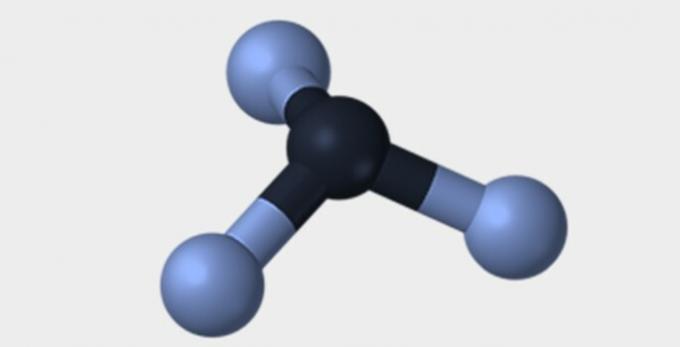 |
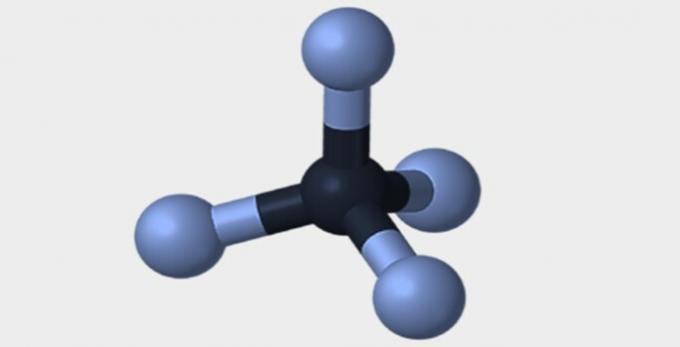 |
 |
Molekul polar dan non polar
Molekul diklasifikasikan menurut polaritas.
molekul nonpolar: tidak ada perbedaan keelektronegatifan antar atom.
| Nitrogen (N2) | karbon dioksida (CO2) |
|---|---|
 |
 |
Nitrogen (N2) adalah molekul non-polar karena dibentuk olehnya unsur kimia dan karena itu tidak ada perbedaan keelektronegatifan. karbon dioksida (CO2) adalah non-polar karena geometri liniernya, yang menstabilkan daya tarik oksigen oleh elektron.
molekul polar: ada perbedaan keelektronegatifan antar atom, dengan kutub positif dan kutub negatif.
| Air (H2HAI) | Amonia (NH3) |
|---|---|
 |
 |
Dalam kedua contoh, kita melihat bahwa atom pusat, oksigen dan nitrogen, memiliki pasangan elektron tidak berpasangan yang membentuk awan elektron. Karena ada lebih banyak awan elektronik di sekitar atom pusat daripada ikatan kimia yang terbentuk, molekulnya bersifat polar.
Contoh molekul
| Zat | fitur | Molekul | Rumus |
|---|---|---|---|
| Hidrogen | Bahan bakar dan melimpah di kerak bumi. | 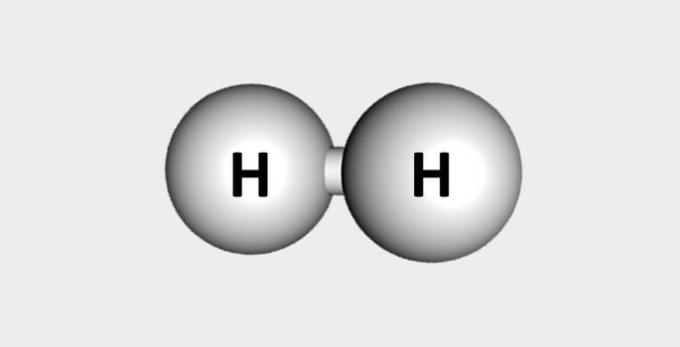 |
H2 |
| Oksigen | Penting untuk bernafas dan berpartisipasi dalam berbagai reaksi kimia | 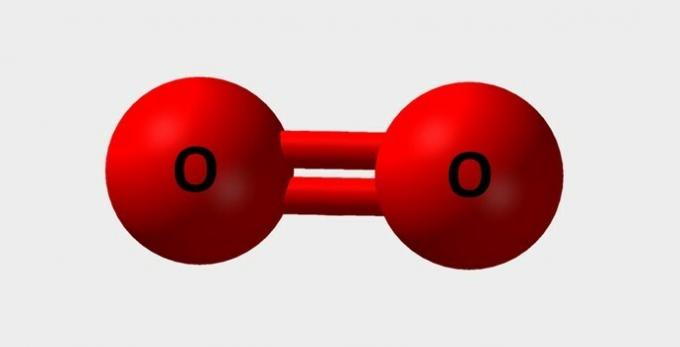 |
HAI2 |
| Sulfur | Bubuk kuning digunakan untuk membuat pewarna. | 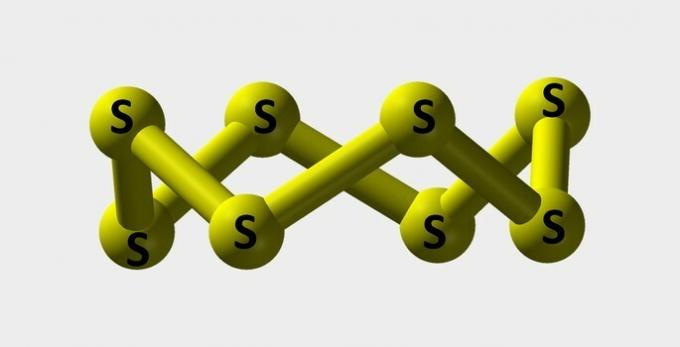 |
s8 |
| Karbon dioksida | Digunakan dalam alat pemadam kebakaran dan pendingin. | 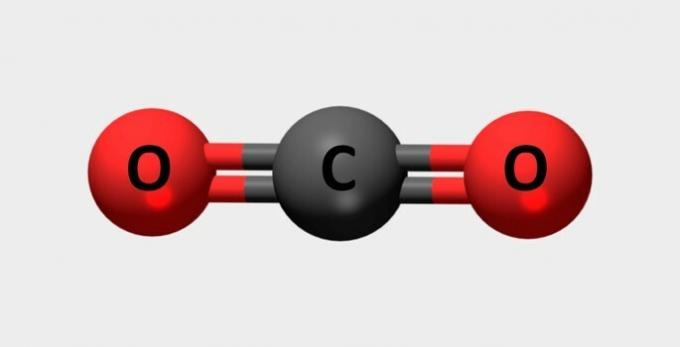 |
BERSAMA2 |
| etanol | Alkohol umum digunakan sebagai bahan bakar dan parfum. | 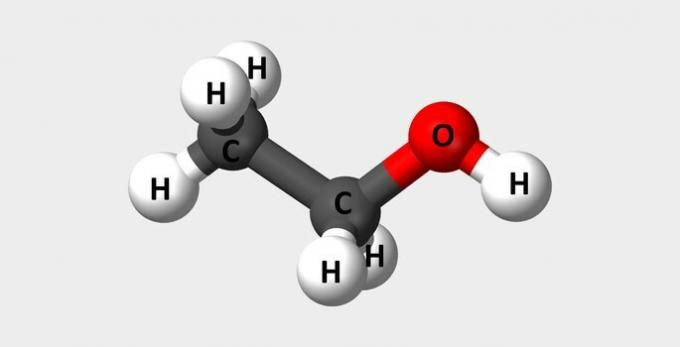 |
Ç2H6HAI |
Pastikan untuk membaca teks-teks ini tentang topik yang terkait dengan apa yang baru saja Anda pelajari:
- Biomolekul
- Senyawa organik
- Massa molekul
- Aturan Oktet
- Ikatan kimia
- Polaritas Koneksi
- Gaya antarmolekul



