Model atom muncul dari kebutuhan untuk menjelaskan struktur atom. Ketika bukti baru tentang konstitusi atom disajikan, model atom baru mencoba untuk memperjelas temuan.
Filsuf Yunani Democritus dan Leucipo pada abad V;. disebut atom, dari bahasa Yunani oμoν, partikel tak terpisahkan dan bagian terkecil dari materi.
Meskipun konsep atom sudah tua, perkembangan teori atom dimulai pada abad ke-19 dan ke-20. Oleh karena itu, model atom utama yang dikembangkan untuk memahami sifat materi adalah:
- Model Atom Dalton (1803) — "Model Bola Biliar"
- Model Atom Thomson (1898) — "Model Puding Hujan"
- Model Atom Rutherford (1911) — "Model Nuklir"
- Model Atom Bohr (1913) — "Model Planet"
- Model Atom Kuantum (1926) — "Model Awan Elektronik"

Model atom Dalton
Upaya pertama yang diakui untuk menggambarkan atom datang dari ilmuwan Inggris John Dalton (1766-1844) dalam model yang kemudian dikenal sebagai "bola biliar".
Atom Dalton (1803): bola besar, tak terpisahkan, dan tak bisa dihancurkan.

Menurut Dalton:
- Semua zat dibentuk oleh atom;
- Atom-atom dari suatu unsur kimia adalah identik dalam ukuran dan karakteristik, sedangkan atom dari unsur kimia yang berbeda berbeda;
- Zat adalah hasil reaksi kimia, yang terdiri dari rekombinasi atom.
Poin negatif: Karena elektron belum diketahui ketika Dalton merumuskan teorinya, partikel-partikel ini, yang sekarang kita ketahui sebagai bagian dari atom, tidak dipertimbangkan.
Belajar lebih tentang Model atom Dalton.
Model Atom Thomson
Joseph John Thomson (1856-1940) bertanggung jawab untuk menemukan keberadaan elektron, partikel yang bermuatan negatif dan merupakan bagian dari atom. Penemuan ini menjungkirbalikkan teori atom Dalton, bahwa atom tidak dapat dibagi lagi, tetapi dibentuk oleh partikel yang lebih kecil lagi dan, oleh karena itu, dikenal sebagai "puding kismis".
Atom Thomson (1898): bola bermuatan positif dengan elektron tetap.

Menurut Thomson:
- Atom bersifat netral secara listrik;
- Elektron menempel pada permukaan bermuatan positif;
- Ada tolakan antara elektron yang didistribusikan dalam atom.
Poin negatif: Meskipun Thomson memperhitungkan keberadaan elektron, atom bukanlah bola positif, melainkan diberkahi dengan partikel bermuatan positif, proton, diidentifikasi pada tahun 1886 oleh ilmuwan Eugene Goldstein dan kemudian dikonfirmasi oleh Ernest Rutherford.
Belajar lebih tentang Model atom Thomson.
Model Atom Rutherford
Melalui eksperimennya Ernest Rutherford (1871-1937) berhasil menunjukkan bahwa atom bukanlah partikel tak terpisahkan seperti yang diyakini, melainkan dibentuk oleh partikel yang lebih kecil.
Atom Rutherford (1911): inti bermuatan positif dan elektron terletak di sekitarnya di elektrosfer.

Menurut Rutherford:
- Atom memiliki daerah pusat dengan konsentrasi muatan positif yang tinggi;
- Massa atom terkonsentrasi di wilayah pusatnya;
- Elektron lebih ringan dan terletak di sekitar nukleus, wilayah yang mengandung banyak ruang kosong.
Poin negatif: Inti atom tidak hanya memiliki partikel bermuatan positif, tetapi ada juga partikel subatomik lainnya, yaitu neutron, yang ditemukan oleh James Chadwick pada tahun 1932. Selanjutnya, model yang diajukan oleh Rutherford tidak menjelaskan emisi cahaya oleh atom.
Belajar lebih tentang Model atom Rutherford.
Model atom Bohr
Mencari untuk menjelaskan mengapa elemen memancarkan warna karakteristik ketika terkena beberapa kondisi dan berdasarkan Model atom Rutherford, Niels Bohr (1885-1962) mengajukan teori atom yang menjelaskan pancaran cahaya di tempat-tempat tertentu. frekuensi.
Atom Bohr (1913): elektron bergerak dalam lapisan melingkar tetap di sekitar nukleus.

Menurut Bohr:
- Elektron bergerak dalam lapisan di sekitar nukleus;
- Lapisan di sekitar inti memiliki nilai energi tertentu;
- Untuk pergi ke tingkat yang lebih eksternal, elektron harus menyerap energi. Setelah kembali ke lapisan yang lebih dekat ke inti, elektron melepaskan energi.
Poin negatif: Tidak dapat dikatakan bahwa elektron bergerak mengelilingi inti dalam posisi tetap seperti planet mengelilingi Matahari.
Belajar lebih tentang Model atom Bohr.
Model Atom Kuantum
Banyak ilmuwan telah berkontribusi pada pengembangan mekanika kuantum, yang mencoba menjelaskan struktur "yang lebih nyata" dari a atom oleh kombinasi dari beberapa penelitian dan, oleh karena itu, ini adalah yang paling kompleks.
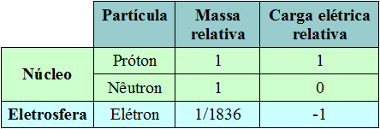
Atom kuantum (1926): inti terdiri dari proton (muatan positif) dan neutron (muatan nol), dan elektron (muatan negatif) membentuk awan elektronik di sekitar inti.

Menurut model atom kuantum:
- Inti terdiri dari proton dan neutron. Karena hanya proton yang memiliki muatan, nukleus bermuatan positif;
- Elektron membentuk awan elektronik di sekitar inti;
- Elektron bergerak dalam orbital, dalam ruang tiga dimensi;
- Posisi elektron yang tepat tidak dapat ditentukan. Apa yang dilakukan adalah perhitungan yang menentukan probabilitas daerah yang akan ditempati elektron dalam waktu tertentu.
Kamu bilangan kuantum memiliki fungsi untuk menemukan elektron. Apakah mereka:
HAI bilangan kuantum utama (n) mewakili tingkat energi, yaitu lapisan elektronik atom.
HAI bilangan kuantum sekunder (l) menunjukkan sublevel energi, yaitu sublevel energi yang dimiliki elektron.
HAI bilangan kuantum magnetik (m) adalah salah satu yang menunjukkan orbit di mana elektron bertemu.
Belajar lebih tentang model atom dan uji pengetahuan Anda dengan latihan model atom.