Atom adalah partikel kecil tak terhingga yang menyusun semua materi di alam semesta. Seiring waktu, gagasan tentang seperti apa struktur atom berubah sesuai dengan penemuan-penemuan baru yang dibuat oleh para ilmuwan. Anda dapat mengetahui lebih lanjut tentang ini di teksEvolusi Model Atom.
Model adalah representasi dari realitas (bukan realitas itu sendiri), jadi model atom adalah representasi dari komponen utama atom dan strukturnya dan menjelaskan perilaku fisik dan kimia tertentu dari materi. Hal ini dilakukan karena manusia belum mungkin melihat atom yang terisolasi bahkan dengan ultramikroskop.
Untuk mendapatkan gambaran tentang seberapa kecil atom, ketahuilah itu Itu Partikel terkecil yang terlihat di bawah mikroskop biasa mengandung lebih dari sepuluh miliar atom! Atom sangat kecil sehingga, jika kita menempatkan satu juta dari mereka berdampingan, kita tidak akan mencapai ketebalan sehelai rambut.
Peta Pikiran: Atom
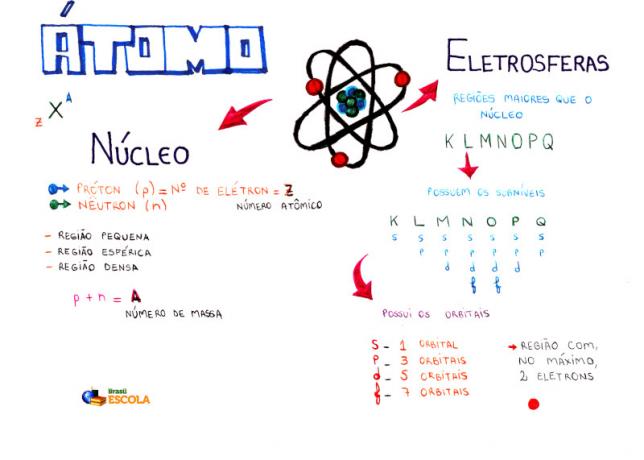
* Untuk mengunduh peta pikiran dalam PDF, Klik disini!
Di antara model atom, yang paling banyak digunakan saat ini di sekolah menengah untuk memahami struktur atom dan sifat-sifatnya adalah model Rutherford-Bohr. Menurut model ini, struktur atom terdiri dari dua bagian utama:
inti dan elektrosfer.
Dua bagian utama dari struktur atom - elektrosfer dan nukleus
* Inti: Merupakan bagian tengah atom, padat, masif dan sangat padat, selain dibentuk oleh partikel bermassa lebih besar, yaitu proton dan neutron.

Ilustrasi proton dan neutron yang membentuk inti atom
- Proton: mereka adalah partikel dengan muatan listrik positif (muatan relatif = +1; muatan dalam coulomb (C) = +1,602. 10-19) dan massa relatifnya sama dengan 1.
Fakta bahwa proton membentuk nukleus dan memberinya muatan positif keseluruhan ditemukan oleh Eugen Goldstein, pada tahun 1886, melalui modifikasi ampul Crookes dan beberapa percobaan. Dia melihat bahwa, di bawah tegangan yang sangat tinggi, emisi muncul (sinar anoda - sisa-sisa atom gas yang ada di dalam bohlam dan elektronnya terkoyak oleh pelepasan listrik). Dengan menempatkan medan listrik atau magnet di luar bola lampu, sinar ini dibelokkan ke arah kutub negatif. Ini berarti bahwa ada partikel subatom positif, yang disebut proton.
Kemudian, Ernest Rutherford (1871-1937) melakukan percobaan yang dijelaskan dalam teks Atom Rutherford, yang membawanya untuk menemukan lokasi proton: di dalam nukleus.
- Neutron: mereka adalah partikel dengan massa yang sama dengan proton (1), tetapi seperti namanya, mereka netral, yaitu, mereka tidak memiliki muatan listrik.
Neutron ditemukan pada tahun 1932 oleh James Chadwick (1891-1974), yang menyadari bahwa inti berilium radioaktif memancarkan partikel netral dengan massa kira-kira sama dengan massa proton (sebenarnya, itu sedikit lebih besar).
Jangan berhenti sekarang... Ada lagi setelah iklan ;)
Diameter inti tergantung pada jumlah proton dan neutron yang dimiliki atom, tetapi rata-rata sekitar 10-14 bulan 10-15 m.
Inti atom memusatkan hampir seluruh massa atom, menjadi bagian yang sangat kecil: baik proton dan neutron sekitar 100.000 kali lebih kecil dari seluruh atom itu sendiri! Sebagai perbandingan, bayangkan kita memperbesar inti atom unsur hidrogen (yang hanya memiliki proton) seukuran bola tenis, elektron terdekat akan berjarak sekitar tiga kilometer dari jarak! Bahkan jika sebuah atom diperbesar hingga setinggi gedung 14 lantai, intinya hanya seukuran sebutir garam di lantai tujuh. Ini benar-benar sesuatu yang luar biasa, bukan begitu?!
* Elektrosfer: Aku s daerah di mana elektron berputar di sekitar inti. Meskipun merupakan wilayah dengan volume yang jauh lebih besar daripada inti, ia praktis kosong, karena setiap elektron 1836 kali lebih kecil dari 1 proton (atau dari 1 neutron). Itu sebabnya massa atom hampir seluruhnya berada di dalam inti. Elektron adalah partikel dengan muatan listrik negatif (-1).
Elektron ditemukan pada tahun 1897 oleh Joseph John Thomson (1856-1940), pencipta Model atom Thomson. Eksperimen Thomson dapat dilihat secara rinci dalam teks Eksperimen Thomson dengan muatan listrik, tetapi singkatnya, dia menggunakan ampul Crookes yang disebutkan di atas dan menyadari bahwa sinar katoda selalu tertarik oleh kutub positif, yang membuktikan bahwa atom memiliki partikel negatif, yang disebut elektron.
Elektron berputar di sekitar nukleus miliaran kali per sejuta detik, membentuk atom dan membuatnya berperilaku seolah-olah padat.
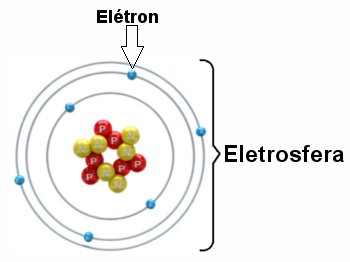
Ilustrasi elektrosfer dengan tiga lapisan elektronik dan elektron yang berputar mengelilingi inti.
Secara singkat, kita dapat membuat tabel untuk membedakan tiga partikel subatom utama yang merupakan bagian dari struktur atom:

Massa dan muatan listrik dari tiga partikel subatom utama - proton, neutron dan elektron
Atom-atom dari semua unsur kimia terdiri dari tiga partikel subatomik ini. Yang membedakan satu unsur kimia dengan unsur lainnya adalah jumlah kemunculan partikel-partikel tersebut, terutama jumlah proton di dalam nukleus, yang disebut nomor atom. Terus belajar tentang hal itu melalui teks. elemen kimia.
* Mind Map oleh Saya Diogo Lopes
Oleh Jennifer Fogaa
Lulus kimia
Kimia
Klasifikasi materi, air, gas hidrosianat, karbon dioksida, amonia, hidrogen, helium, zat sederhana, zat majemuk, campuran, fase campuran, campuran homogen, campuran heterogen.

