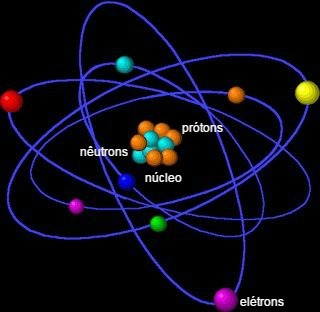
Atom adalah unit dasar materi dan fraksi terkecil yang mampu mengidentifikasi unsur kimia, karena memegang identitasnya. Istilah atom berasal dari bahasa Yunani yang berarti tidak dapat dibagi.
Ini terdiri dari nukleus, yang mengandung neutron dan proton, dan elektron yang mengelilingi nukleus.
struktur atom
Atom terdiri dari partikel-partikel kecil, disebut juga partikel sub atoms: elektron, proton dan neutron.
Sebagian besar massa atom terkonsentrasi di nukleus, wilayah kecil yang padat. Volume terbesarnya ditemukan di elektrosfer, tempat ruang kosong, saat elektron mengorbit di sekitar nukleus.
elektron
HAI elektron ia memiliki muatan listrik negatif (-1) dan hampir tidak memiliki massa, karena nilainya 9,11 x 10-28 g e sekitar 1840 kali lebih kecil dari massa inti. Mereka adalah partikel kecil yang berputar sangat cepat di sekitar inti atom.
Elektron yang ditemukan di daerah terluar atom bertanggung jawab untuk pembentukan ikatan kimia, yang terjadi melalui sumbangan, penerimaan atau pembagian elektron.
proton
HAI proton ia memiliki muatan listrik positif (+1) dengan nilai absolut yang sama dengan muatan elektron. Dengan cara ini, proton dan elektron cenderung menarik satu sama lain secara elektrik.
Melalui proton dimungkinkan untuk membedakan unsur-unsur kimia, karena setiap atom suatu unsur memiliki jumlah proton yang ditentukan dalam intinya, yang disebut nomor atom.
neutron
HAI neutron tidak memiliki muatan sama sekali, yaitu netral secara listrik. Bersama dengan proton, ia membentuk inti atom, yang membawa seluruh massa atom (99,9%). Baik proton dan neutron memiliki massa sekitar 1,67 x 10-24 g. Nilai ini mewakili 1 satuan massa atom.
Neutron memberikan stabilitas pada inti atom, karena gaya nuklir menyebabkannya tertarik pada elektron dan proton.
Hanya atom hidrogen yang tidak memiliki neutron, karena hanya terdiri dari elektron yang berputar di sekitar proton.
Periksa tabel di bawah untuk abstrak dengan informasi tentang partikel subatom.
| Partikel | Simbol |
Semacam spageti (dalam satuan massa atom) |
Biaya (dalam satuan muatan listrik - u.c.e) |
Lokasi |
|---|---|---|---|---|
| Proton | +1 | inti | ||
| neutron | 0 | inti | ||
| Elektron | -1 | elektrosfer |
Sebuah atom dalam keadaan dasarnya adalah netral secara listrik, karena jumlah proton sama dengan jumlah elektron dan muatan yang berlawanan, positif dan negatif, saling meniadakan.
Misalnya, natrium (Na) memiliki nomor atom 11, yaitu intinya memiliki 11 proton. Akibatnya, ada 11 elektron di elektrosfer atom unsur itu.
Baca lebih lanjut tentang struktur atom.
komposisi atom
Seperti yang telah kita lihat, atom dibentuk oleh daerah pusat yang kecil dan padat yang disebut nukleus dan di sekelilingnya terdapat a elektrosfer, tempat elektron berada, yang dapat dibagi menjadi lapisan elektronik, sublevel energi dan orbital atom.
lapisan elektronik
atom menyajikan tingkat energi, yang sesuai dengan tujuh lapisan di sekitar nukleus dan di dalamnya ada elektron yang mengorbit di sekitarnya. Lapisan-lapisan tersebut disebut K, L, M, N, O, P dan Q.
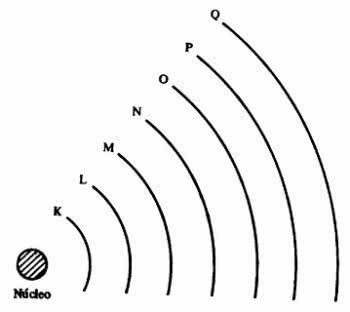
Setiap kulit dapat berisi sejumlah elektron, seperti yang ditunjukkan pada tabel di bawah ini.
| Tingkat energi | lapisan elektronik | Jumlah maksimum elektron |
|---|---|---|
| 1º | K | 2 |
| 2º | L | 8 |
| 3º | saya | 18 |
| 4º | tidak | 32 |
| 5º | HAI | 32 |
| 6º | P | 18 |
| 7º | Q | 8 |
Misalnya, atom helium (He) memiliki nomor atom 2 dan karena itu memiliki 2 proton di dalam nukleus. Akibatnya, di elektrosfer atom hanya ada 2 elektron, yang terletak di kulit elektron pertama dan satu-satunya atom, kulit K yang sesuai dengan tingkat energi pertama.
Sublevel energi
Tingkat energi subtingkat rumah, yang diwakili oleh s, p, d, f. Setiap sublevel menampung jumlah elektron maksimum, yaitu masing-masing 2, 6, 10 dan 14.

Dengan informasi ini, dimungkinkan untuk distribusi elektronik atom dan mengetahui lokasi elektron terluar dan paling energik.
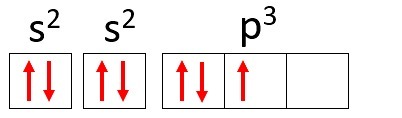
Contoh: Nitrogen (N)
Nomor Atom: 7
Distribusi elektronik: 1s2 2 detik2 2p3
Atom nitrogen memiliki dua tingkat energi, K dan L, dan 7 elektronnya menempati sublevel s dan p.
K: s2 = 2 elektron
L: s2 + p3 = 5 elektron
Perhatikan bahwa kulit L dapat berisi hingga 8 elektron, tetapi dalam atom nitrogen hanya ada 5 elektron di kulit itu.
orbital atom
Orbital mencirikan wilayah yang paling mungkin untuk menemukan elektron dalam sublevel energi (s, p, d, f) dalam kulit elektronik (K, L, M, N, O, P, Q).
- sublevel s: memiliki 1 orbital yang menampung hingga 2 elektron
- sublevel p: memiliki 3 orbital yang menampung hingga 6 elektron
- Sublevel d: memiliki 5 orbital yang menampung hingga 10 elektron
- Sublevel f: memiliki 7 orbital yang menampung hingga 14 elektron
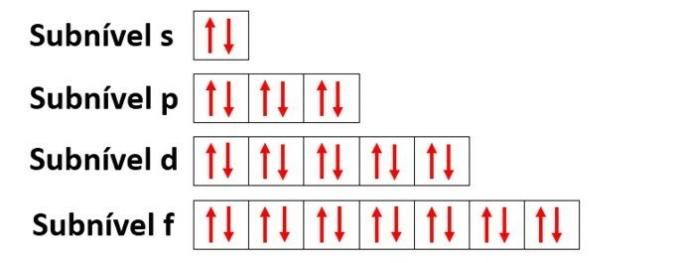
Menggunakan nitrogen lagi sebagai contoh dan mendistribusikan 7 elektronnya dalam orbital atom, kita akan mendapatkan:
Jenis atom
Mengamati jumlah proton, neutron dan elektron kita dapat membandingkan atom dan mengklasifikasikannya menjadi isotop, isobar dan isoton.
Unsur kimia dapat didefinisikan sebagai sekelompok atom dengan jumlah proton yang sama. Atom-atom ini disebut isotop karena memiliki nomor atom yang sama dan massa yang berbeda.
Misalnya, di alam ada 3 isotop unsur hidrogen (H): protium , deuterium
dan tritium
.
Atom dari unsur kimia yang berbeda dapat diklasifikasikan sebagai isoton ketika mereka memiliki nomor atom dan massa yang berbeda, tetapi jumlah neutron yang sama.
Isobar adalah atom dari unsur yang berbeda, yaitu memiliki nomor atom yang berbeda, tetapi nomor massa yang sama.
Baca lebih lanjut tentang isotop, isobar, dan isoton.
Model atom (model atom)
Filsuf Yunani Aristoteles (384 a.. - 322 C) mencoba menjelaskan susunan semua zat mulai dari unsur bumi, udara, api dan air.
Demokritus (546 a. C - 460a. C), seorang ilmuwan dan matematikawan Yunani, merumuskan gagasan bahwa ada batas kecilnya partikel. Dia berkata bahwa mereka akan menjadi sangat kecil sehingga tidak dapat lagi dibagi-bagi. Dia menyebut partikel ini sebagai "atom".
Untuk sebagian besar abad ke-19, itu adalah Model Atom Dalton, ilmuwan Inggris, yang mengusulkan teori atom, yang jauh melampaui pemikiran orang dahulu.
Teori ini mengatakan bahwa semua zat terdiri dari partikel kecil yang tidak dapat dibagi lagi yang disebut atom, yang akan menjadi seperti bola bilyar. Sebagai studi tentang struktur materi maju, ditemukan bahwa atom dibentuk oleh partikel kecil lainnya yang disebut subatomik.
Dengan ditemukannya elektron, thomson ia merumuskan model yang dikenal sebagai puding massa, yang menggambarkan atom sebagai bola positif dengan elektron bermuatan negatif yang tertanam di permukaannya.
Melalui eksperimen fisikawan Rutherford menemukan bahwa atom memiliki rongga dan elektron di sekitar inti positif yang sangat kecil. Dengan demikian, Rutherford mengusulkan model nuklir untuk mewakili atom.
Bohr memperbaiki model yang diusulkan oleh Rutherford dengan menemukan bahwa elektron tidak berputar di sekitar nukleus secara acak, tetapi dalam orbit tertentu. Model ini kemudian dikenal sebagai planetarium.
Baca juga tentang:
- Model atom
- Model Atom Thomson
- Model Atom Bohr
- Model Atom Rutherford
- Evolusi model atom