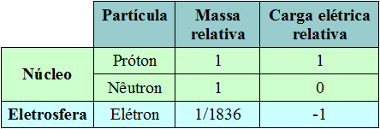
Lapisan Valensi adalah lapisan terakhir dari distribusi elektronik atom. Karena merupakan lapisan terluar, ia juga merupakan yang terjauh dari inti atom.
Menurut Aturan Oktet, kulit valensi membutuhkan delapan elektron untuk stabil.
Dengan demikian, atom memperoleh stabilitas ketika mereka memiliki 8 elektron di kulit valensi. Ini terjadi dengan gas mulia, mereka memiliki lapisan valensi lengkap. Satu-satunya pengecualian adalah unsur Helium yang memiliki 2 elektron.
Unsur-unsur lain perlu membuat ikatan kimia untuk menerima elektron yang hilang dan mencapai delapan elektron di kulit valensi.
Elektron kulit valensi adalah orang-orang yang berpartisipasi dalam ikatan, karena mereka adalah yang paling eksternal.
Lapisan Elektrosfer
Menurut model atom Rutherford-Bohr, elektron berputar di sekitar inti atom, dalam lapisan energi yang berbeda.
Ada tujuh lapisan yang ditunjuk oleh huruf K, L, M, N, O, P dan Q. Masing-masing mendukung jumlah elektron maksimum.
 Lapisan elektronik dan jumlah elektron yang didukungnya
Lapisan elektronik dan jumlah elektron yang didukungnya
Baca juga:
- Model atom Bohr
- Model Atom Rutherford
- Gas mulia
- Aturan Oktet
Bagaimana cara menentukan Layer Valencia?
Lapisan valensi dapat ditentukan dengan dua cara: Distribusi elektronik dan Tabel periodik.
Untuk menentukan lapisan valensi melalui distribusi elektronik, Diagram Linus Pauling.
 diagram pauling
diagram pauling
Ingatlah bahwa diagram Pauling mengikuti urutan peningkatan energi. Lapisan terakhir yang diperoleh dalam distribusi elektronik adalah lapisan valensi.
1 detik2 2 detik2 2p6 3 detik2 3p6 4s2 3d10 4p6 5 detik2 4d10 5p6 6 detik2 4f14 5d10 6p6 7 detik2 5f14 6d10 7p6
Jadi, pada lapisan valensi, sublevel yang paling energik adalah lapisan terakhir.
Contoh:
Nitrogen - N
Nomor Atom: 7
Distribusi elektronik: 1s2 2 detik2 2p3
Lapisan Valencia: 2s2 2p3, N memiliki 5 elektron pada kulit valensi.
Besi - Fe
Nomor Atom: 26
Distribusi elektronik: 1s2 2 detik2 2p6 3 detik2 3p6 4s2 3d6
Lapisan Valencia: 4s2, Fe memiliki 2 elektron pada kulit valensinya.
Klorin - Cl
Nomor Atom: 17
Distribusi elektronik: 1s2 2 detik2 2p6 3 detik2 3p5
Lapisan Valencia: 3s2 3p5, Cl memiliki 7 elektron pada kulit valensinya.
Oksigen - O
Nomor atom: 8
Distribusi elektronik: 1s2 2 detik2 2p4
Lapisan Valencia: 2s2 2p4, oksigen memiliki 6 elektron pada kulit valensinya.
Karbon - C
Nomor atom: 6
Distribusi elektronik: 1s2 2 detik2 2p2
Lapisan Valencia: 2s2 2p2, karbon memiliki 4 elektron pada kulit valensinya.
Baca juga tentang Bilangan kuantum.
Sampai saat ini, contoh yang digunakan adalah dengan elemen dalam keadaan dasar. Tetapi prinsip yang sama dapat digunakan untuk ion, kation dan anion. Lihat contohnya:
Klorida Anion - Cl-
Nomor atom klorin adalah 17. Jika dalam keadaan dasar, jumlah elektron akan sama dengan jumlah proton. Namun, dalam hal ini ada keuntungan 1 elektron.
Pertama, buat distribusi elektronik untuk elemen Klorin:
1 detik2 2 detik2 2p6 3 detik2 3p5
Dengan mendapatkan elektron ekstra, tambahkan di lapisan terakhir:
1 detik2 2 detik2 2p6 3 detik2 3p6. Jadi ada 8 elektron di kulit valensi (3s2 3p6).
Lihat juga: Latihan tentang distribusi elektronik.
Untuk menentukan lapisan valensi melalui tabel periodik, perlu dilakukan identifikasi periode dan golongan unsur.
Jadi, sementara keluarga 1A memiliki 1 elektron valensi, 2A memiliki 2, dan seterusnya. Unsur kimia yang terkandung di dalamnya keluarga tabel periodik memiliki jumlah elektron yang sama pada kulit valensi.
Namun, ini hanya berlaku untuk golongan 1, 2, 13, 14, 15, 16 dan 17 yang masing-masing memiliki jumlah elektron berikut pada kulit valensi 1, 2, 3, 4, 5, 6 dan 7.
Untuk elemen di mana hubungan ini tidak memungkinkan, distribusi elektronik harus digunakan.
Jangan lupa! Di ikatan kimia timbul dari kebutuhan untuk menstabilkan atom dan dengan demikian membentuk molekul. Ini dilakukan dengan mendonorkan elektron dari kulit valensi, yang karena lebih jauh dari nukleus, memiliki kecenderungan untuk menyumbang.
Baca juga tentang Geometri Molekuler.
Latihan
1. Temukan lapisan valensi dari unsur-unsur berikut:
Brom
35br
1 detik2 2 detik2 2p6 3 detik2 3p6 4s2 3d10 4p5
Kulit valensi Brom (keluarga 7A) memiliki 7 elektron. Itu karena 4s2 dan 4p5 milik lapisan N, sedangkan 3d10 termasuk dalam lapisan M.
Aluminium
13Al
1 detik2 2 detik2 2p6 3 detik2 3p1
Kulit valensi aluminium (keluarga 3A) memiliki 3 elektron.
2. (UFSC) Jumlah elektron di setiap sublevel atom strontium (38Sr) dalam urutan energi menaik adalah:
a) 1s2 2 detik2 2p6 3 detik2 3p6 4s2 3d10 4p6 5 detik2
b) 1s2 2 detik2 2p6 3 detik2 3p6 4s2 4p6 3d10 5 detik2
c) 1s2 2 detik2 2p6 3 detik2 3p6 3d10 4s2 4p6 5 detik2
d) 1s2 2 detik2 2p6 3 detik2 3p6 4p6 4s2 3d10 5 detik2
e) 1s2 2 detik2 2p6 3p6 3 detik2 4s2 4p6 3d10 5 detik2
a) 1s2 2 detik2 2p6 3 detik2 3p6 4s2 3d10 4p6 5 detik2
3. (IFSP/2013) Jumlah elektron pada kulit valensi atom kalsium (Z = 20), pada keadaan dasar, adalah
ke 1
b) 2
c) 6
d) 8
e) 10
b) 2
Periksa pertanyaan ujian masuk dengan resolusi komentar di: Latihan pada Tabel Periodik.