Zat terlarut dan pelarut adalah dua komponen campuran homogen yang disebut larutan kimia.
- terlarut: adalah zat yang terdispersi dalam pelarut. Ini sesuai dengan zat yang akan dilarutkan dan, umumnya, muncul dalam jumlah yang lebih kecil dalam larutan.
- Pelarut: adalah zat dimana zat terlarut akan dilarutkan untuk membentuk produk baru. Ini menampilkan dirinya dalam jumlah yang lebih besar dalam larutan.
Pembubaran antara zat terlarut (terdispersi) dan pelarut (pendispersi) terjadi melalui interaksi antara molekul mereka.
Perbedaan antara kedua komponen larutan ini adalah bahwa zat terlarut adalah zat yang akan larut dan pelarut adalah zat yang akan mempengaruhi pembubaran.
Pelarut yang paling terkenal adalah air, dianggap sebagai pelarut universal. Itu karena ia memiliki kemampuan untuk melarutkan sejumlah besar zat.
Contoh Pelarut dan Pelarut
Lihat beberapa contoh larutan kimia dan temukan zat terlarut dan pelarut dari masing-masing larutan tersebut:
Air dan garam
- Zat terlarut: Garam meja - Natrium klorida (NaCl)
- Pelarut: Air
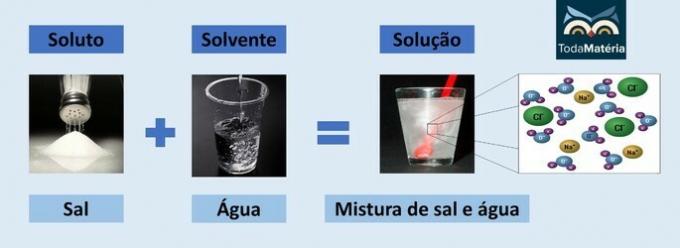
Karena merupakan senyawa ionik, natrium klorida dalam larutan berdisosiasi dan membentuk ion yang, pada gilirannya, dilarutkan oleh molekul air.
Kutub positif air (H+) berinteraksi dengan anion garam (Cl-) dan kutub negatif air (O2-) berinteraksi dengan kation (Na+).
Ini adalah jenis larutan elektrolit, karena spesies ionik dalam larutan mampu menghantarkan arus listrik.
air dan gula
- Zat terlarut: Gula - Sukrosa (C12H22HAI11)
- Pelarut: Air

Gula adalah senyawa kovalen dan ketika dilarutkan dalam air molekul mereka bubar tetapi tidak mengubah identitas mereka.
Larutan berair ini diklasifikasikan sebagai non-elektrolitik, karena zat terlarut yang terdispersi dalam larutan bersifat netral dan, oleh karena itu, tidak bereaksi dengan air.
Cuka
- Zat terlarut: Asam asetat (CH3COOH)
- Pelarut: Air

Cuka adalah larutan yang mengandung setidaknya 4% asam asetat, a asam karboksilat yang, menjadi polar, berinteraksi dengan air, juga polar, melalui ikatan hidrogen.
Aturan penting untuk kelarutan adalah bahwa suka larut seperti. Senyawa polar dilarutkan dalam pelarut polar, sedangkan zat non polar larut dalam pelarut non polar.
Solusi lainnya
Selain larutan cair, ada juga larutan gas dan padat.
Udara yang kita hirup adalah contoh larutan gas, yang gasnya lebih banyak adalah nitrogen (78%) dan oksigen (21%).
Di paduan logam mereka adalah solusi yang solid. Misalnya, kuningan (seng dan tembaga) adalah campuran yang digunakan untuk membuat alat musik.
Ingin menambah ilmu? Jadi bacalah teks-teks lainnya ini:
- Solusi Kimia
- gaya antarmolekul
- Campuran homogen dan heterogen
Apa itu Koefisien Kelarutan?
Koefisien kelarutan adalah batas zat terlarut yang ditambahkan ke pelarut pada suhu tertentu untuk membentuk larutan jenuh.
HAI koefisien kelarutan bervariasi sesuai dengan kondisi, dan dapat meningkat atau menurun sesuai dengan perubahan suhu dan zat terlarut yang bersangkutan.
Ada batas di mana pelarut dapat melakukan pembubaran.
Contoh: Jika Anda memasukkan gula ke dalam segelas air, pada saat pertama, Anda akan melihat bahwa gula menghilang di dalam air.
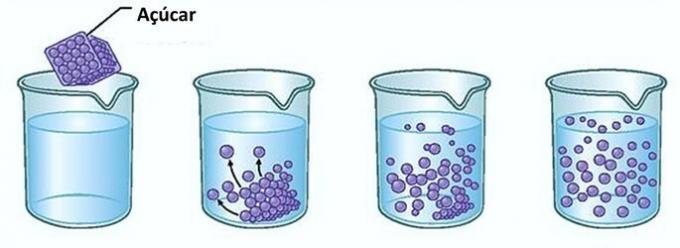
Namun, jika Anda terus menambahkan gula, Anda akan menemukan bahwa pada titik tertentu gula akan mulai menumpuk di dasar gelas.
Hal ini karena air, yang merupakan pelarut, telah mencapai batas kelarutan dan konsentrasi maksimum. Zat terlarut yang tetap berada di dasar wadah dan tidak larut disebut tubuh latar belakang.
Kelebihan gula di dasar gelas tidak akan larut dan tidak akan mempengaruhi konsentrasi larutan. Selain itu, gula yang disimpan di dasar gelas tidak akan membuat air menjadi lebih manis.
Klasifikasi solusi
Larutan dapat diklasifikasikan berdasarkan jumlah zat terlarut. Dengan demikian, mereka dapat terdiri dari tiga jenis: jenuh, tidak jenuh, dan lewat jenuh.
- larutan jenuh: Larutan telah mencapai batas koefisien kelarutan, yaitu terdapat jumlah maksimum zat terlarut dalam pelarut pada suhu tertentu.
- larutan tak jenuh: Jumlah zat terlarut belum mencapai koefisien kelarutan. Ini berarti bahwa lebih banyak zat terlarut dapat ditambahkan.
- larutan lewat jenuh: Ada lebih banyak zat terlarut daripada dalam kondisi normal. Dalam hal ini, mereka menghadirkan endapan.
Untuk mempelajari lebih lanjut tentang solusi, baca teks berikut.:
- Pengenceran larutan
- Molalitas
- Molaritas
- Titrasi
Konsentrasi solusi
Dari zat terlarut dan pelarut adalah mungkin untuk menghitung konsentrasi larutan.
Konsentrasi umum didefinisikan sebagai rasio massa zat terlarut dalam volume tertentu larutan.
Perhitungan konsentrasi dilakukan dengan menggunakan rumus sebagai berikut:
Makhluk,
Ç: Konsentrasi (g/L);
saya: massa zat terlarut (g);
V: volume larutan (L).
Contoh:
(Faap) Hitung konsentrasi, dalam g/L, larutan berair natrium nitrat yang mengandung 30 g garam dalam 400 mL larutan:
Resolusi:
Amati informasi mengenai jumlah zat terlarut dan pelarut. Ada 30 g garam (zat terlarut) dalam 400 mL larutan berair (pelarut).
Namun, volumenya dalam mL dan kita perlu mengubahnya menjadi L:
Nah, untuk mengetahui konsentrasinya, Anda hanya perlu menerapkan rumus:
Dengan hasil ini, kami mencapai kesimpulan bahwa ketika kami mencampur 30 g garam dengan 400 mL air, kami akan mendapatkan larutan dengan konsentrasi 75 g/L.
Untuk informasi lebih lanjut tentang cara menghitung konsentrasi umum, teks-teks ini akan membantu.:
- Konsentrasi Solusi
- Latihan tentang Konsentrasi Umum

