Menurut model orbital yang dibuat oleh Linus Pauling pada tahun 1960, ikatan kovalen yang membentuk molekul terjadi oleh fusi atau interpenetrasi orbital tidak lengkap dari unsur-unsur yang terlibat dalam Tautan. Dengan demikian, disimpulkan bahwa jika suatu unsur memiliki orbital yang tidak lengkap (dengan hanya satu elektron), ia hanya dapat membuat ikatan kovalen. Jika memiliki dua orbital yang tidak lengkap, ia dapat membuat maksimum dua koneksi dan seterusnya.
Namun, lihat orbital atom dari unsur atom karbon, yang memiliki nomor atom sama dengan 6 (Z = 6):
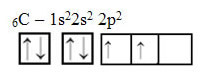
Perhatikan bahwa ia memiliki dua orbital yang tidak lengkap, jadi ia hanya boleh melakukan paling banyak dua ikatan. Namun, bukan itu yang terjadi padanya. Seperti yang diketahui banyak orang, karbon membentuk empat ikatan (tetravalen), jadi model orbital ini tidak menjelaskan kasus karbon.
Untuk mengakhiri kebuntuan ini, sebuah teori baru diciptakan untuk menjelaskan masalah ini dengan lebih baik: the Teori Hibridisasi.

Ini berarti bahwa hibridisasi adalah "campuran" orbital murni.
Untuk karbon ada tiga jenis hibridisasi, yaitu: sp3, sp2 dan sp.
Untuk memahami bagaimana hibridisasi terjadi, mari kita lihat tipe pertama dari hibridisasi karbon, yaitu tipe sp.3:
Jenis hibridisasi ini terjadi pada molekul metana (CH4). Perhatikan bahwa ada empat ikatan kovalen yang identik antara karbon, yang merupakan elemen pusat, dan empat hidrogen. Jadi, lihat apa orbital hidrogen yang tidak lengkap:
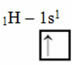
Karena setiap hidrogen memiliki orbital tipe-s yang tidak lengkap, maka perlu untuk menerima satu elektron lagi, yaitu, masing-masing hanya membuat satu ikatan kovalen dengan karbon. Itu sebabnya karbon perlu memiliki empat orbital yang tidak lengkap. Bagaimana ini terjadi? Melalui hibridisasi.
Ketika sebuah elektron dari orbital 2s menyerap energi, ia masuk ke orbital 2p yang kosong. Jadi, kita katakan bahwa lompatan elektron dari sublevel 2s ke 2p ini adalah "promosi" elektron. Dengan cara ini, karbon tetap dalam keadaan tereksitasi atau teraktivasi, dengan empat orbital hibridisasi yang tersedia untuk melakukan ikatan kovalen:
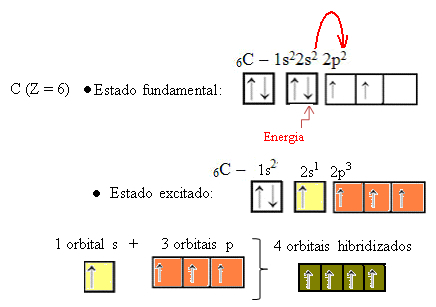
Perhatikan bahwa orbital hibrida yang terbentuk setara satu sama lain, tetapi berbeda dari orbital murni aslinya.
Dengan cara ini, ikatan antara orbital s dari masing-masing empat atom hidrogen terjadi dengan empat orbital karbon hibridisasi ini:
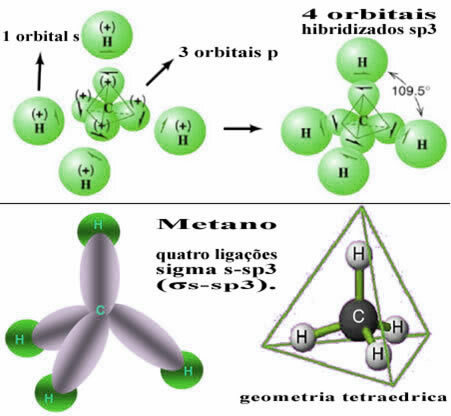
Seperti yang terlihat di atas, molekul metana memiliki struktur tetrahedron yang teratur, dengan empat awan elektron di setiap titik dan sudut yang berdekatan 109°28'. Karena ikatan dibuat antara orbital s dari setiap hidrogen dan orbital sp hibridisasi3 untuk setiap koneksi, maka kita memilikinya tautan empat sigma s-sp3 (σs-sp3).
Oleh Jennifer Fogaa
Lulus kimia
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm

