mendefinisikan dirinya sebagai hibridisasi penyatuan orbital atom yang tidak lengkap. Orbital diklasifikasikan sebagai tidak lengkap jika hanya memiliki satu elektron di dalamnya, bukan dua. Lihat representasi orbital tidak lengkap dan orbital lengkap:

Pada gambar A, kita memiliki orbital lengkap; pada gambar B, orbital tidak lengkap.
Hibridisasi adalah fenomena alam yang terjadi dengan beberapa unsur kimia, seperti Fosfor, Sulfur, Karbon, dll. Hibridisasi karbon memungkinkan atom-atom unsur ini mampu membuat empat ikatan kimia, yaitu, karbon hanya membuat empat ikatan setelah mengalami fenomena hibridisasi.
Tetapi mengapa karbon berhibridisasi dan membuat empat ikatan? Untuk memahami fenomena ini, kita harus mengetahui distribusi elektronik elemen ini:
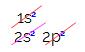
Dalam distribusi elektronik karbon, kita melihat bahwa sublevel 1s lengkap (dengan dua elektron), 2s adalah lengkap (dengan dua elektron) dan sublevel 2p tidak lengkap (sublevel p mendukung enam elektron, tetapi hanya ada dua). Mendistribusikan elektron 2p secara representatif, kita harus:
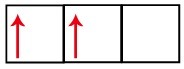
Sublevel p memiliki tiga orbital – dalam kasus karbon, dua di antaranya tidak lengkap dan satu kosong. Untuk alasan ini, elemen ini hanya boleh melakukan dua tautan, karena jumlah orbital yang tidak lengkap selalu menentukan jumlah tautan.
Namun, ketika menerima energi dari lingkungan eksternal, elektron yang ada dalam karbon tereksitasi. Jadi, salah satu elektron yang ada di sublevel 2s bergerak ke orbital sublevel p yang kosong:
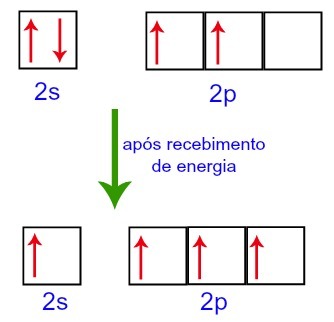
Orbital Karbon sebelum dan sesudah menerima energi dari lingkungan luar
Dengan demikian, karbon yang tersisa dengan empat orbital yang tidak lengkap di tingkat kedua. Kemudian, orbital dari sublevel 2s bergabung dengan tiga orbital p, yang mengonfigurasi fenomena hibridisasi.
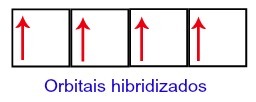
Orbital karbon setelah hibridisasi
Oleh Saya Diogo Lopes Dias
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm