Baterai adalah perangkat di mana arus listrik dihasilkan dari energi kimia yang berasal dari reaksi oksidasi reduksi, yaitu, satu spesies reaktan kehilangan elektron (oksidasi), sedangkan spesies lain memperoleh elektron (reduksi).
Lihat representasi reaksi oksidasi dan reduksi yang terjadi pada tumpukan apa pun:
Oksidasi: X → dan + X+
Spesies X kehilangan elektron dan berubah menjadi kation.
Pengurangan: kamu- + dan → Y
anion Y- menangkap elektron dan berubah menjadi spesies Y netral.
Komponen dasar tumpukan
Komponen dasar dari stack adalah:
Anoda: elektroda negatif di mana reaksi oksidasi berlangsung, yaitu kehilangan elektron;
Katoda: elektroda positif tempat berlangsungnya reaksi reduksi, yaitu perolehan elektron;
Larutan elektrolit (jembatan garam) atau bahan konduktif (seperti batang grafit): adalah cara elektron yang dilepaskan oleh anoda mencapai katoda.
Dasar-dasar cara kerja baterai
Fungsi tumpukan terjadi dari peristiwa berikut:
Prinsip 1: Oksidasi anoda
Logam di anoda, karena memiliki kecenderungan lebih besar untuk kehilangan elektron, menjadi kation, seperti yang kita amati dalam persamaan di bawah ini:
Zn → Zn2+ + 2 dan
Prinsip ke-2: reduksi katoda
Kation yang merupakan bagian dari bahan yang ada di katoda (kita akan menggunakan tembaga sebagai contoh), saat menerima elektron dari anoda berubah menjadi logam tembaga, seperti yang dapat kita lihat pada persamaan di bawah:
Pantat2+ + 2e → Cu
tumpukan pertama
a) Baterai Alessandro Volta
Tumpukan belakang Alessandro (tumpukan pertama dalam sejarah), dirakit pada tahun 1800, dibentuk oleh cakram logam yang diselingi, seperti pada gambar di bawah ini:

Perakitan mirip dengan Alessandro's Back to your pile
Cakram tersebut disisipkan karena memiliki komposisi yang berbeda. Satu terbuat dari logam seng, dan yang lainnya terbuat dari tembaga, selalu dipisahkan oleh kapas yang direndam dalam air garam (larutan yang dibentuk oleh air dan garam).
B) tumpukan Daniell
Tumpukan Daniell, dirakit pada tahun 1836, terdiri dari dua setengah sel yang dihubungkan oleh kawat penghantar dan jembatan garam.
Setengah sel 1: itu adalah anoda, yaitu kutub negatif baterai.
Itu terdiri dari pelat seng, dan sebagian dari pelat ini terendam dalam larutan yang dibentuk oleh air dan seng sulfat (ZnSO4).
Setengah sel 2: itu adalah katoda, yaitu kutub positif baterai.
Itu terdiri dari pelat tembaga, dan sebagian dari pelat ini terendam dalam larutan yang dibentuk oleh air dan tembaga sulfat (CuSO4).
jembatan garam
Tabung berbentuk U yang berisi larutan yang dibentuk oleh air dan kalium klorida (KCl), yang menghubungkan dua setengah sel (seng dan tembaga) dan memiliki wol kaca di kedua ujungnya.
baterai saat ini
Saat ini ada beberapa model tumpukan, tetapi secara umum terlihat seperti ini:
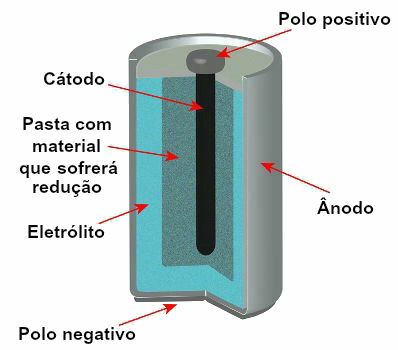
Skema yang mewakili model tumpukan saat ini
Model yang paling banyak digunakan adalah yang disebut baterai Leclanché dan baterai alkaline, yang memiliki perbedaan sebagai berikut:
Itu) Tumpukan Leclanche
Ini memiliki anoda yang dibentuk oleh seng logam;
Ini memiliki katoda yang dibentuk oleh pasta dengan amonium klorida, air, pati dan mangan dioksida;
Ia memiliki batang grafit yang berfungsi sebagai konduktor untuk elektron yang berangkat dari katoda menuju anoda.
B) Baterai alkaline
Ini memiliki anoda yang dibentuk oleh seng logam atau kadmium;
Ini memiliki katoda yang dibentuk oleh oksida merkuri, oksida nikel dan yodium;
Itu harus memiliki basis campuran dalam bahan yang membentuk katoda.
Oleh Saya Diogo Lopes Dias
Sumber: Sekolah Brasil - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-pilha.htm
