Seperti yang ditunjukkan dalam teks "Spektrum elektromagnetik Unsur Kimia" dan "Spektrum Emisi dan Penyerapan dan Hukum Kirchhoff”, spektrum emisi terputus-putus setiap unsur kimia berbeda.

Jadi, di bawah ini kami memiliki spektrum yang berbeda dari beberapa elemen ini:

Jadi, fisikawan Denmark Niels Böhr (1885-1962) menyadari bahwa ini dapat dikaitkan dengan struktur atom dari masing-masing elemen ini. Oleh karena itu, ia mengusulkan model atom yang melengkapi model Rutherford, tetapi berfokus pada perilaku elektron di sekitar inti atom.
Beberapa waktu sebelumnya, Max Planck (1858-1947) telah mengajukan teori bahwa elektron adalah terkuantisasi, dalam arti bahwa mereka memancarkan dan menyerap energi dalam jumlah tertentu, seolah-olah itu adalah paket energi kecil, yang dia sebut berapa banyak (kuantum, dalam bentuk tunggal).
Dengan demikian, Böhr mengusulkan hal berikut: karena setiap elemen memiliki spektrum yang berbeda, setiap elemen memiliki elektron dalam atomnya dengan energi yang konstan dan berbeda dari elemen ke elemen.
Setiap elektron hanya dapat tinggal di orbit tertentu, karena di setiap orbit ini elektron memiliki energi yang konstan, terdefinisi dengan baik dan karakteristik. Elektron hanya dapat menempati tingkat energi yang memiliki energi masing-masing.
Jangan berhenti sekarang... Ada lagi setelah iklan ;)
Spektrum tidak kontinu karena elektron terkuantisasi.
Elektron hanya dapat berubah level jika menyerap energi. Misalnya, ketika Anda membakar garam natrium dalam pembakar Bunsen, Anda memasok energi ke elektron. Ketika menyerap energi kuantum, elektron melompat ke tingkat lain yang lebih energik, tetap dalam keadaan tereksitasi. Namun, keadaan dasar lebih stabil, sehingga elektron ini memancarkan energi yang diserap dan kembali ke orbit aslinya. Ini memancarkan energi ini dalam bentuk gelombang elektromagnetik yang dapat divisualisasikan dalam bentuk cahaya. Dalam kasus natrium, cahaya ini berwarna kuning pekat. Jadi, ketika gelombang-gelombang ini melewati prisma, spektrum natrium yang terputus-putus diperoleh.
Jadi, untuk Bohr, setiap garis bercahaya yang muncul dalam spektrum unsur-unsur yang terputus menunjukkan energi yang dilepaskan ketika elektron kembali dari satu tingkat terluar ke tingkat yang lebih dekat ke inti.
Gambar di bawah membantu untuk lebih memahami masalah ini:
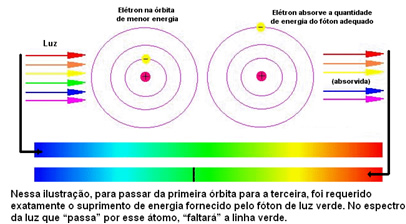
Karena atom dari setiap unsur hanya diperbolehkan nilai energi tertentu yang sesuai dengan lapisan energi, untuk setiap unsur terdapat spektrum yang berbeda.
Oleh Jennifer Fogaa
Lulus kimia
Apakah Anda ingin mereferensikan teks ini di sekolah atau karya akademis? Lihat:
FOGAÇA, Jennifer Rocha Vargas. "Spektra Elektromagnetik dan Struktur Atom"; Sekolah Brasil. Tersedia di: https://brasilescola.uol.com.br/quimica/espectros-eletromagneticos-estrutura-atomo.htm. Diakses pada 27 Juni 2021.


