Asam hidroklorik adalah hidrat dengan potensi ionisasi tinggi, itu adalah cairan kekuningan, sangat korosif dan beracun. Ini digunakan dalam berbagai proses industri, seperti pembuatan produk pembersih dan hidroklorida farmasi, dalam makanan dan dalam proses pembuatan baja.
Hal ini juga hadir dalam organisme manusia; HAI jus lambung yang berperan dalam pencernaan protein adalah larutan asam; dari hidroklorida dan zat lainnya, seperti: enzim dan garam. Paparan, inhalasi atau konsumsi asam klorida pekat sangat berbahaya bagi kesehatan, yang bahkan dapat menyebabkan kematian.
Baca juga: Asam sulfat - zat yang memiliki daya korosif yang tinggi
Sifat asam klorida
- senyawa anorganik
- asam kuat
- Potensi ionisasi tinggi
- Cair
- penampilan kekuningan
- Racun
- Korosif
- Lincah
- Higroskopis (cenderung menyerap áair dari lingkungan)
- Larut dalam air
Jangan berhenti sekarang... Ada lagi setelah iklan ;)
Produksi asam klorida
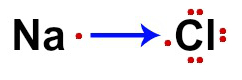
Asam klorida adalah ditemukan oleh seorang alkemis muslim
disebut Jabir Ibne Haiane, juga dikenal sebagai Gaber dan dianggap sebagai bapak kimia Arab. Dia mensintesis zat berdasarkan a reaksi antara garam laut (NaCl) dan asam sulfat (Di2HANYA4).2NaCl + H2HANYA4 → Dalam2HANYA4 + 2HCl
Saat ini asam klorida diproduksi secara besar-besaran melalui elektronikólisis natrium klorida dalam larutan berair. Dari proses ini diperoleh gas klorin (Cl2), gas hidrogen (H2) dan natrium hidroksida (NaOH). Gas klorin dan hidrogen bereaksi membentuk asam klorida:
Cl2 + H2 → 2HCl
Namun, reaksi ini sangat eksotermis dan sangat berbahaya. Saat ini, sebagian besar asam klorida yang diproduksi secara industri dikaitkan dengan produksi senyawa organik, menjadi proses yang lebih ekonomis dan lebih aman.
R-H + Cl2 → R-Cl + HCl
(Pertimbangkan R sebagai radikal organik.)
Lihat juga: Tips untuk menentukan-jika kekuatan asam

Aplikasi asam klorida
- pengawetan logam: Asam klorida digunakan untuk "membersihkan" logam sebelum diproses, menghilangkan karat, kerak, dan kotoran lainnya dari permukaannya.
- Produksi senyawa organik: asam klorida digunakan sebagai reagen untuk mendapatkan vinil klorida, yang digunakan dalam pembuatan plastik. Asam klorida juga berasal dari kloroprena, yang digunakan dalam karet sintetis.
- Produksi senyawa anorganik: asam klorida hadir dalam beberapa proses industri untuk pembuatan reagen dan senyawa Produk anorganik antara lain produk untuk pengolahan air, seperti besi(III) klorida dan besi (III) klorida. aluminium.
- Digunakan sebagai produk pembersih: Juga dipasarkan sebagai asam muriat, asam klorida digunakan untuk pembersihan peralatan dan mesin pasca konstruksi, domestik, dan kimia.
- Pengolahan makanan: Asam klorida digunakan dalam berbagai reaksi untuk produksi makanan dan aditif, seperti hidrolisis pati dan protein, atau dalam produk akhir untuk keseimbangan pH.
- Produksi obat: Asam klorida digunakan dalam produksi hidroklorida larut yang terdapat dalam beberapa obat, seperti doksisiklin hidroklorida, yang digunakan dalam pengobatan demam tifoid dan cacar.
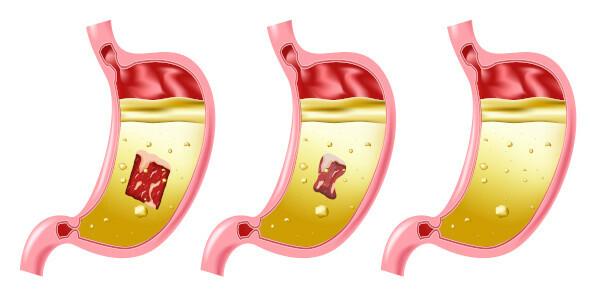
Asam klorida dalam tubuh
Asam klorida hadir di kami sistem pencernaan, jus lambung yang dihasilkan oleh perut kita adalah larutan air, enzim, asam klorida, garam anorganik dan sebagian kecil asam laktat.
HAI kue makanan diubah menjadi chyme, massa asam (berkat aksi jus lambung dan komposisi asamnya), inilah saatnya pencernaan protein, berubah menjadi polipeptida dan asam amino yang akan diserap oleh tubuh.
Bahaya Asam Hidroklorida
Asam klorida adalah asam yang sangat kuat dan korosif, sehingga kontak dengan zat tersebut menyebabkan beberapa kerusakan:
- Kulit: Menyebabkan luka bakar dan iritasi.
- mata: Menyebabkan iritasi parah dan dapat menyebabkan kebutaan.
- Inhalasi: Menyebabkan iritasi dan cedera pada saluran udara bagian atas.
- proses menelan: menyebabkan korosi di seluruh sistem mulut, dan di saluran pencernaan, dapat menyebabkan muntah, pendarahan, diare, masalah sirkulasi, yang dapat menyebabkan kematian.
- Paparanbersambung: menyerang daerah mukosa terlebih dahulu, menyebabkan dermatitis dan konjungtivitis, gusi berdarah, fotosensitisasi; sering terhirup, bahkan dalam konsentrasi senyawa yang rendah, dapat menyebabkan radang perut dan mimisan.
Juga akses: Karakteristik dan sifat asam asetat

latihan yang diselesaikan
Pertanyaan 1 - (Udesc) Mengenai asam klorida, dapat dinyatakan bahwa:
A) ketika dalam larutan air, memungkinkan lewatnya arus listrik.
B) adalah asam.
C. merupakan asam lemah.
D) memiliki tingkat ionisasi yang rendah.
E) adalah zat ionik.
Resolusi
Alternatif A Asam klorida bukan asam karena hanya memiliki satu H yang dapat terionisasi, tetapi satu asam kuat, zat molekuler dengan potensi ionisasi tinggi. ITU ionisasi dalam media berair mempromosikan konduksi arus listrik karena adanya ion bebas.
Pertanyaan 2 - Dalam larutan asam klorida dan air, kita dapat mengatakan bahwa terjadinya molekul hidrogen klorida (HCl) minimal, hal ini karena
A) asam klorida dalam kontak dengan air diencerkan.
B) hidrogen klorida adalah zat yang tidak larut dalam air.
C) hidrogen klorida memiliki potensi ionisasi yang tinggi, oleh karena itu, ketika dalam media berair, molekul HCl membentuk ion H+ Cl-.
D) asam klorida, karena sangat mudah menguap, terpisah dari larutan, hanya menyisakan molekul air.
E) asam klorida adalah zat ionik, oleh karena itu, dalam larutan berair, ia berdisosiasi, membentuk ion.
Resolusi
Alternatif C.
A) Jawabannya tidak sesuai dengan pertanyaan, mengencerkan asam klorida dalam air tidak membenarkan tidak adanya molekul HCl.
B) Salah, hidrogen klorida larut dan memiliki afinitas terhadap air.
C) Benar
D) Meskipun asam klorida mudah menguap, pemisahan dua spesies dalam larutan ini tidak terjadi secara signifikan.
E) Asam klorida adalah larutan hidrogen klorida dan air, di mana hidrogen klorida adalah zat molekul non-ionik.
Oleh Laysa Bernardes Marques de Araujo
guru kimia
Apakah Anda ingin mereferensikan teks ini di sekolah atau karya akademis? Lihat:
ARAúJO, Laysa Bernardes Marques de. "Asam hidroklorik"; Sekolah Brasil. Tersedia di: https://brasilescola.uol.com.br/quimica/Acido-cloridrico.htm. Diakses pada 27 Juni 2021.