Egy pufferelési megoldás olyan keverék, amelyet arra használnak, hogy megakadályozza a tápközeg pH-jának vagy pOH-jának változását erős savak vagy erős bázisok hozzáadásakor.
Kétféle pufferoldat létezik:
1. Gyenge sav és konjugátum bázisának keveréke;
2. Gyenge bázis keveréke a konjugált savval.
Nézzünk meg példákat mindegyikre és azok működésére, amikor kis mennyiségű erős savat vagy bázist adunk a táptalajhoz:
1. A gyenge sav és a konjugált bázis keveréke:
Ilyen oldat kialakításához a gyenge savat összekeverjük a savval azonos anion sójával.
Vegyünk egy ecetsavat (H3CCOOH(itt)) és nátrium-acetát (H3CCOONas). Lásd, hogy mindkettőnek van acetát-anionja: (H3CCOO-(itt)). Ezen ionok koncentrációja gyakorlatilag a só disszociációjának köszönhető, amely nagy. A savionizáció kicsi.

Most vegye észre, mi történik a következő kiegészítési lehetőségekben:
- Kis mennyiségű erős sav hozzáadása:
Erős sav hozzáadása növeli a hidroniumion, H koncentrációját3O+1és mivel az ecetsav gyenge sav, az acetátanion nagy affinitással rendelkezik a protonhoz (H+) hidronium. Ily módon reagálnak és több ecetsav képződik:

Ennek eredményeként a közeg pH-ja gyakorlatilag nem változik. Ha azonban egyre több erős savat adunk hozzá, akkor eljön az idő, amikor az összes acetátanion elfogy, és a pufferhatás megszűnik.
- Kis mennyiségű erős bázis hozzáadása:
Erős bázis hozzáadása növeli az OH-ionok koncentrációját-. De ezeket az ionokat a H ionok semlegesítik3O+1 felszabadul az ecetsav ionizációja során:

Ezzel a reakcióval a H-ionok koncentrációja3O+1(itt) csökken, és elmozdul az egyensúly a savas ionizáció fokozása szempontjából, ezért az oldat pH-változása nagyon kicsi lesz. A H-ionok koncentrációja3O+1(itt) gyakorlatilag állandó lesz.
Ne álljon meg most... A reklám után még több van;)
Ebben az esetben van egy felső korlát kapacitás is. Ezért ha egyre több bázist adunk hozzá, akkor a savionizáció egyensúlya egyre inkább az ionizációja felé tolódik el, amíg az összes sav el nem fogy.
2. Gyenge bázis keveréke a konjugált savval:
Ez a fajta pufferoldat gyenge bázisból és sóoldatból áll, amelyek ugyanazt a kationt tartalmazzák, mint a bázis.
Vegyünk például egy magnézium-hidroxid, MgOH által képzett pufferoldatot2 (aq) (gyenge bázis) és magnézium-klorid, MgCl2 (s) (só). Mindkettő magnézium-kationt tartalmaz (Mg2+(itt)). A közegben jelen lévő magnéziumionok gyakorlatilag mind a só disszociációjából származnak, mivel a bázis disszociációja gyenge:
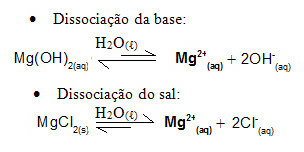
- Kis mennyiségű erős sav hozzáadása:
Ebben az esetben a H-ionok3O+1 az erős sav hozzáadásából származó OH-ionok semlegesítik-, gyenge bázis disszociációból származik. Ez az alap disszociációs egyensúlyt jobbra tolja.
Így a pH-változás (ha van ilyen) nagyon kicsi lesz, mert az OH-ionok koncentrációja- állandó marad. A puffer hatás megszűnik, ha a teljes bázis disszociálódik.
- Kis mennyiségű erős bázis hozzáadása:
A hozzáadott erős bázis disszociáción megy keresztül, felszabadítva az OH-ionokat-. Mivel a magnézium-hidroxid gyenge bázis, a sótól disszociálódva felszabaduló magnézium nagyobb hajlandósággal reagál az OH-val-:

Ezért az OH-ionok növekedése- ellensúlyozza az Mg (OH) arányos növekedése2 (aq). Ennek eredményeként a pH nem megy át jelentős változásokon.
Ez a hatás akkor ér véget, amikor az összes magnézium-kation elfogyott.
Írta: Jennifer Fogaça
Kémia szakon végzett
Hivatkozna erre a szövegre egy iskolai vagy tudományos munkában? Néz:
FOGAÇA, Jennifer Rocha Vargas. "Mi az a pufferoldat?"; Brazil iskola. Elérhető: https://brasilescola.uol.com.br/quimica/o-que-uma-solucao-tampao.htm. Hozzáférés: 2021. június 28.
Kémia

Tesztelje tudását, és tudjon meg többet a kémiai egyensúlyokra vonatkozó megoldott gyakorlatok listájával. Ezen az anyagon keresztül jobban meg fogja tudni érteni az egyensúlyi állandók (Kp, Kc és Ki), az egyensúlyi eltolódás, a pH és a pOH, valamint az úgynevezett pufferoldatok egyensúlyának működését.
Megoldás, szilárd megoldás. Folyékony oldat, gáznemű oldat, gáz és folyadék által alkotott oldatok, folyadékok által képzett oldatok.