A szövegben "Koncentráció mol / l vagy molaritás”Látta, hogy a mol / l koncentráció az oldott anyagban lévő anyag mennyiségére vonatkozik (n1, mólban mérve) az oldat térfogatával, literben (V). Vannak azonban olyan oldott anyagok, amelyek vízbe kerülve ionokat képeznek.
Példaként említhetjük, ha sót (NaCl) teszünk a vízbe, és a víz Cl pozitív pólusa és a negatív Na pólusa között vonzás lép fel, ami Na ionokat eredményez.+ és Cl-.
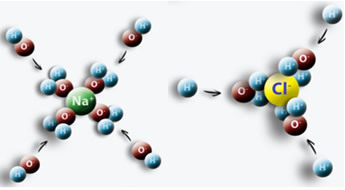
Fontos tudni, hogyan lehet meghatározni ezen ionok mol / l koncentrációját, mivel ez sok helyzetben hasznos lehet. Az egyik ilyen terület a gyógyszer, különösen az orvosi vérvizsgálatok során. Vérünkben és más testnedveinkben feloldódnak az ionok. Ha ezeknek az ionoknak a koncentrációja a vérünkben meghaladja vagy meghaladja a normális szintet, az veszélyeztetheti testünk megfelelő működését, és rendellenességekhez és betegségekhez vezethet.
Lásd a vasionok esetét (Fe2+): ha az illetőnek hiányzik ez az ion, vérszegénység alakulhat ki benne. Így ha valakinek vérszegénysége van, azt mondják, hogy vasban gazdag ételeket vagy akár valamilyen vasat tartalmazó gyógyszert kell fogyasztania, akkor valójában a vasion és nem a fémes elem.
Egy másik eset az, amikor a kalciumionok (Ca2+) csontokban, csontritkulást okozva, amint az a képeken látható, az alábbi csontok nagyított képeivel:

Nézz meg más ionokat, amelyek létfontosságú funkciókkal rendelkeznek a testünkben, és amelyeknek megfelelő koncentrációban kell lenniük:

Ezért ezekre az információkra tekintettel nyilvánvalóvá válik, hogy az oldatokban lévő ionkoncentráció kiszámításának tudása nagyon fontos. De hogyan lehet ezt megtenni?
Meghatározható az oldatokban jelenlévő ionok koncentrációja mol / l-ben, ha két lényeges adat ismert:
- A vízben oldott anyagok képletei;
- Megoldásainak molaritása.
Ezekkel az adatokkal írva írja be a szóban forgó oldott anyag disszociációs vagy ionizációs egyenletét, és levonással keresse meg az ionok koncentrációját, arányos az egyes ionok mólszámával. Ez azt jelenti, hogy az ionok koncentrációja arányos az ionizációs vagy disszociációs egyenletben szereplő együtthatókkal.
Ne álljon meg most... A reklám után még több van;)
A számítás végrehajtásának jobb megértéséhez lásd a következő példát:
"Vegye figyelembe, hogy a magnézium-foszfát (Mg3(POR4)2 0,5 mol / l. Mekkora lesz a magnézium-kationok koncentrációja mol / l-ben (Mg2+(itt)) és foszfátanionok (PO3-4 (aq)) ebben a megoldásban, figyelembe véve, hogy a disszociáció mértéke (α) 100% volt? "
A probléma megoldásának első lépése a disszociációs vagy ionizációs egyenlet megírása. Ha nehézségei vannak, akkor az alábbi általános egyenletre alapozhatja:
1 AxBy → x A+ y + y B-x
1 mol x mol y mol
Tehát figyelembe véve ebben a példában, hogy a magnézium-foszfát teljesen disszociált, a következő egyenlet áll rendelkezésünkre:
1 mg3(POR4)2 (aq) → 3 mg2+(itt) + 2 gp3-4 (aq)
1 mol 3 mol 2 mol
Láthatjuk, hogy 1 mol Mg3(POR4)2 3 mol Mg-ot kap2+(itt) és 2 mol PO3-4 (aq); így a kation móljainak száma háromszorosa lesz annak a foszfátnak a mólszámához képest, amellyel az oldatot készítették, és az anionoké kétszerese lesz.
Mivel az oldat 0,5 mol / l Mg3(POR4)2 (aq) , ez azt jelenti, hogy 1 molban 0,5 mol Mg oldódott3(POR4)2amely 1,5 mol / l Mg-t eredményezett2+(itt) és 1,0 mol / l PO3-4 (aq):
1 mg3(POR4)2 (aq) → 3 mg2+(itt) + 2 gp3-4 (aq)
1 mol 3 mol 2 mol
0,5 mol x y
1. 0,5 3. 0,5 2. 0,5
0,5 mol / l 1,5 mol / l1,0 mol / l
De mi lenne, ha a disszociáció vagy az ionizáció mértéke nem lenne 100%? Tegyük fel, hogy 70% volt, hogyan tudnánk megtudni ezen ionok mol / L koncentrációját?
Ebben az esetben csak hajtson végre egy egyszerű három szabályt. Lásd lentebb:
1,5 mol / l Mg2+(itt) 100 %
x 70%
x = 70. 1,5 → x = 1,05 mol / l Mg ion2+(itt)
100
1,5 mol / l PO3-4 (aq) 100 %
y 70%
y = 70. 1,0 → y = 0,70 mol / l PO-ionok3-4 (aq)
100
Írta: Jennifer Fogaça
Kémia szakon végzett
Hivatkozni szeretne erre a szövegre egy iskolai vagy tudományos munkában? Néz:
FOGAÇA, Jennifer Rocha Vargas. "Ionkoncentráció mol / L-ben"; Brazil iskola. Elérhető: https://brasilescola.uol.com.br/quimica/concentracao-dos-ions-mol-l.htm. Hozzáférés: 2021. június 28.
Kémia

Elhatárolódás és ionizáció, Volta olasz tudós, elektromos áram, Svant svéd fizikai vegyész Svant August Arrhenius, Arrhenius, pozitív ionok, kationok, negatív ionok, anionok, maró nátrium, asztali só, poláris molekulák, disszociáció ión,



