A clapeyron-egyenlet olyan matematikai kifejezés, amely olyan mennyiségeket kapcsol össze, mint pl nyomás (P), térfogat (V), hőmérséklet (T) és az a alkotó részecskék száma (n) tökéletes vagy ideális gáz. Ezt az egyenletet a francia fizikusról nevezték el Pálemileclapeyron és felfogható a. empirikus törvényeinek általánosításaként gázoktökéletesban benGay-Lussac, Charles és Boyle. Alapvető fontosságú volt az ideális gázok tanulmányozása szempontjából, és lehetővé tette a gázok fejlődését Termikus gépek, egyre hatékonyabbá téve őket az elmúlt évtizedekben.
Lásd még: Fizikai felfedezések, amelyek véletlenül történtek
Clapeyron-egyenlet: ideális gáztörvény
Clapeyron egyenlete az három empirikus törvényből származik, vagyis olyan törvények, amelyeket kísérletek alapján határoztak meg. Az ilyen törvények megmagyarázzák a gázok viselkedését gáztranszformációkizovolumetrikus (Gay-Lussac törvény), izobár (Károly törvény) és izotermák (Boyle törvénye). E törvények szerint:
az átalakulásokban izovolumetrikus, az ideális gáz nyomása és termodinamikai hőmérséklete közötti arány állandó marad;
az átalakulásokban izobár, az ideális gáz térfogata és termodinamikai hőmérséklete közötti arány állandó;
- az átalakulásokban izotermák, az ideális gáz nyomásának és térfogatának szorzata állandó marad.
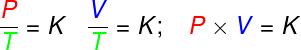
P - nyomás (Pa - pascal)
V - gázmennyiség (m³)
T - termodinamikus gázhőmérséklet (K - kelvin)
A fenti három törvény alapján a Clapeyron-egyenlet meghatározza ennek értékét állandó (K) az előbb említett transzformációk mindegyikében kapott. Clapeyron egyenlete szerint ez az állandó megegyezik a mólok számával, szorozva az a-val állandó R, az ideális gázok univerzális állandójaként ismert és egyenlő Boltzmann állandó szorozva Avogadro száma.
Képlet
Nézze meg az úgynevezett képletet egyenletban benClapeyron:
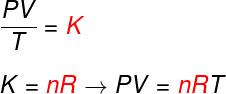
nem - anyajegyek száma (mol)
R - az ideális gázok univerzális állandója (R = 0,082 atm.l / mol. K vagy 8,314 J. mol / K)
A Clapeyron-egyenletet elemezve megállapítható, hogy a nyomás ideális gázok kifejtik közvetlenül arányos a hőmérséklettel és arra is anyajegyek száma. Továbbá, a nyomás fordítottan arányos a térfogattal gáz által elfoglalt.
O ideális gázmodell a Clapeyron-egyenlet lehetővé teszi, széles körben használják a motorral működő gépek fejlesztése folyadékok, például gőzüzemű gépek és belső égésű motorok.
Számos fontos eredmény érhető el a Clapeyron-egyenletből. Egyikük például azt jósolja, hogy 1 mol bármely ideális gáz térfogatát foglalja el 22,4 l amikor nyomásnak van kitéve 1 atm (1,01.105 Pa) és a hőmérsékleten 273K (0 ° C).
Lásd még: A termológia legfontosabb fogalmai
Megoldott gyakorlatok a Clapeyron-egyenleten
1. kérdés - (UECE) Az a gáz, amelynek hőmérsékletét, térfogatát és nyomását a PV = nRT alapján lehet meghatározni, a következő jellemzőkkel rendelkezik:
a) a molekulák közötti nagyon nagy átlagos távolság az intermolekuláris interakciók figyelmen kívül hagyása érdekében, kivéve, ha ütköznek; a molekulák rugalmas ütközéseken mennek keresztül.
b) a molekulák közötti nagyon kicsi átlagos távolság; a molekulák rugalmatlan ütközéseken mennek keresztül.
c) a molekulák közötti nagyon nagy átlagos távolság az intermolekuláris interakciók figyelmen kívül hagyása érdekében, kivéve, ha ütköznek; a molekulák rugalmatlan ütközéseken mennek keresztül.
d) nagyon nagy átlagos távolság a molekulák között és erős intermolekuláris interakciókkal; a molekulák rugalmas ütközéseken mennek keresztül.
Felbontás:
Az ideális gázmodellben nagyszámú dimenzió nélküli részecske mozog nagy sebességgel véletlenszerű irányokban. Az egyetlen kölcsönhatás, amelyet ezek a részecskék szenvednek, a tökéletesen rugalmas ütközések, tehát a helyes alternatíva a betű.
2. kérdés - (UFRGS) Vegye figyelembe a következő állításokat az ideális gázokról.
ÉN. A pV = nRT gázok állapotegyenletében jelen lévő R állandó értéke minden ideális gázra megegyezik.
II. A különböző ideális gázok azonos térfogatú, azonos hőmérsékleten és nyomáson azonos számú molekulát tartalmaznak.
III. Az ideális gáz molekuláinak átlagos mozgási energiája közvetlenül arányos a gáz abszolút hőmérsékletével.
Melyik a helyes?
a) Csak én
b) Csak a II
c) Csak a III
d) Csak az I. és a II
e) I., II. és III
Sablon:
Nézzük meg az alternatívákat:
ÉN. helyes, ezért ideális gázok univerzális állandójának nevezik.
II. helyes. Clapeyron egyenlete szerint, ha két ideális gáz nyomása, hőmérséklete és térfogata megegyezik, akkor a részecskék száma egyenlő.
III. helyes. Az energiaelosztási tétel szerint az ideális gázban lévő részecskék mozgási energiája arányos a hőmérsékletével.
Ezért a helyes alternatíva a e betű.
3. kérdés - (UFJF) A férfiak, mint Clapeyron, Boyle, Mariotte, Gay-Lussac, van der Walls, fontos tanulmányokat dolgoztak ki a gázok tulajdonságaira vonatkozóan. A valós gázok viselkedése megközelíti az alacsony nyomáson ideális gázokat, valamint a nagy térfogatú gázokat és a magas hőmérsékleten tartott gázokat. Vegyük figyelembe, hogy egy laboratóriumi kísérlet során az V térfogatú tartály teljesen zárva van és 1 mol ideális gázt tartalmaz 4,0 nyomás alatt az atm-t 127 ° C-os állandó hőmérsékleten tágulásnak vetik alá, és ennek a gáznak az ideális gáz viselkedése megegyezik az grafikus.
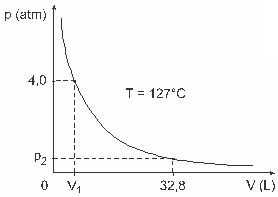
Ebben az esetben, amikor a gáz 32,8 literes térfogatot foglal el, az általa kifejtett nyomás a következő lesz:
(Adva: a tökéletes gázok univerzális állandója R = 0,082 atm. L / mol. K.)
a) 0,32 atm
b) 0,40 atm
c) 1,0 atm
d) 2,0 atm
e) 2,6 atm
Felbontás:
C betű
A gyakorlat megoldásához az adatokat a Clapeyron-egyenletre kell alkalmaznunk, de előtte a Celsius-fokban mért hőmérsékletet kelvinné kell átalakítanunk. Nézze meg:

Írta: Rafael Hellerbock
Fizikatanár
Forrás: Brazil iskola - https://brasilescola.uol.com.br/fisica/a-equacao-clapeyron.htm

