Energiabelső összege kinetikus energiák valamint a test alkotó atomjainak és molekuláinak mozgásával kapcsolatos potenciál. A belső energia is közvetlenül arányos a hőfok a test. Ez egy skaláris mennyiség Joule-ban (SI) mérve, és az olyan változók függvényében határozva meg, mint pl nyomás (P), hangerő (V) és hőfok egy rendszer termodinamikája (T), Kelvinben (K).
Minél magasabb a test hőmérséklete, annál nagyobb a belső energiája, annál nagyobb a képessége, hogy valamilyen munkát végezzen. Ezenkívül például az egyatomos gázok belső energiáját kizárólag a kinetikus energia a gáz minden atomjának. A molekuláris gázok, például a diatomiás gázok kezelésekor figyelembe kell venni a molekuláris kölcsönhatásokat, és ezt a belső energiát a molekulák mozgási energiájának és a közöttük lévő potenciális energiának az összege határozza meg ők.
Az ideális egyatomos gázok belső energiája
Mivel az ideális egyatomos gáz atomjai között nincs kölcsönhatás, belső energiája kizárólag két változótól függ: a mólok számától (n) és a gáz hőmérsékletétől (T). Néz:
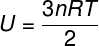
U - belső energia
nem - anyajegyek száma
R - tökéletes gázok univerzális állandója
T - hőfok
A fenti egyenletben R modulusa 0,082 atm. L / mol. K vagy 8,31 J / mol. K (SI). A fenti egyenletet megírhatjuk egyéb mennyiségek, például nyomás és térfogat szempontjából is. Ehhez emlékeznünk kell a Clapeyron egyenlete, ideális gázokhoz használják.
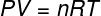
Helyettesítve a fenti egyenletet az előzővel, a következő kifejezést kapjuk a belső energia kiszámításához:
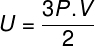
Nézis:Mi a tökéletes gáz?
A fenti egyenleteket figyelembe véve meg lehet határozni az ideális egyatomos gáz atomjainak mozgási energiája és hőmérséklete közötti kapcsolatot. Ehhez kijelentjük, hogy az ilyen típusú gáz kinetikus energiája az tisztánkinetika. Néz:
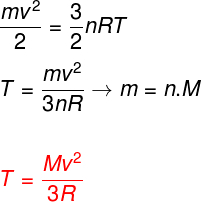
m - tészta
nem - anyajegy száma
M - moláris tömeg
Sok helyzetben érdekes tudni, hogyan lehet kiszámítani a gáz belső energiájának (ΔU) változását, mivel ez a mennyiség jelzi, hogy a gáz megkapta vagy feladta energia. Ha a gáz belső energiájának változása pozitív volt (ΔU> 0), akkor a gáz energiát fog kapni; különben (ΔU <0), a gáz feladja energiájának egy részét.
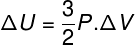
Belső energiaváltozás a gázmennyiség változásában.
Belső energia diatomi gázokhoz
Az ideális diatomi gázok esetében a belső energiát egy kissé eltérő egyenlet adja.
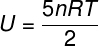
Belső energia termodinamikai átalakulásokban és ciklusokban
Szerint a A termodinamika 1. törvénye, az ideális gáz belső energiája bizonyos mértékben változhat termodinamikai transzformációk, a környezet és a rendszer között kicserélt hő mennyiségétől, valamint a rendszer által vagy a rendszeren végzett munkától függően.
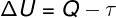
Q - hő
τ - munka
Ezután nézzük meg, hogy ez a törvény milyen formát ölt bizonyos termodinamikai átalakulásokra.
Nézis:A hőgépek története
→ Belső energia: izoterm átalakulás
Nál nél izoterm átalakulás, nincs hőmérsékletváltozás, ezért a belső energia állandó marad.
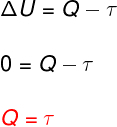
Ebben az esetben a rendszerrel kicserélt teljes hőmennyiség munkává alakul és fordítva.
→ Belső energia: izovolumetrikus transzformáció
Nál nél izovolumetrikus transzformáció, nem lehet munkát végezni, mivel a rendszer egy merev és olcsóbb tartályba van zárva. Ebben az esetben a rendszerrel kicserélt teljes hőmennyiség közvetlenül megváltoztatja a belső energiáját.
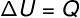
→ Belső energia: izobár átalakulás
Az ilyen típusú átalakítás során a rendszert a állandó nyomásezért az általa vagy rajta végzett munka analitikusan kiszámítható.
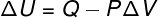
→ Belső energia: adiabatikus transzformáció
Ban,-ben adiabatikus transzformációk, nincsenek hőcserék a rendszer és környezete között, ezért a belső energia változása kizárólag a rendszer által elvégzett munkától függ.
Belső energia ciklikus folyamatokban
Minden ciklikus folyamatban a rendszer termodinamikai állapota, amelyet nyomás-, térfogat- és hőmérsékleti változói (P, V, T) képviselnek, átalakul, de végül visszatér az eredeti állapotba (P, V, T), ezért a belső energia változása az ilyen típusú folyamatokban mindig nulla (ΔU = 0).
Nézis:Ciklikus transzformációk
Nézze meg az alábbi grafikont, amely három különböző termodinamikai transzformációt mutat be az A és B állapot között.
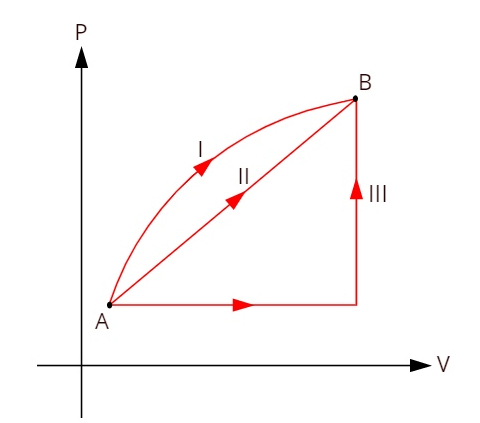
Mivel a három átalakulás (I, II és III) elhagyja az A állapotot és B állapotba megy, a belső energiaváltozásnak mindegyiknek egyenlőnek kell lennie, ezért
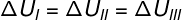
Belső energiagyakorlatok
1) Két mol 24 g / mol moláris tömegű ideális diatomiás gáz található 500 K hőmérsékleten egy zárt, merev tartályban, amelynek térfogata 10 egyenlő.-3 m³. Határozza meg:
a) A belső energia energiamodulja joule-ban.
b) A nyomás, amelyet a gáz gyakorol a tartály falaira.
Felbontás:
A) Mivel ideális és diatomi gáz, az alábbi képletet használjuk a belső energia kiszámításához:
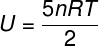
A gyakorlati kimutatásban közölt adatokat figyelembe véve a következő számítást kell megoldanunk:
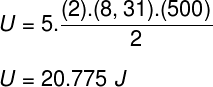
B) Meg tudjuk határozni a gáz nyomását, ha ismerjük a tartályának térfogatát: 10-3 m³. Ehhez a következő képletet fogjuk használni:
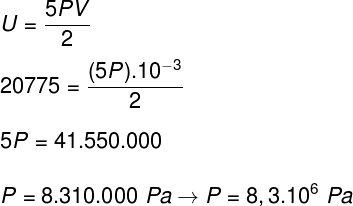
Általam. Rafael Helerbrock
Forrás: Brazil iskola - https://brasilescola.uol.com.br/fisica/energia-interna.htm
