A halogénezési reakciók a szerves szubsztitúciós reakciók egyik típusa, vagyis azok, amelyekben a atomot vagy atomcsoportokat egy másik molekula atomjai vagy atomcsoportjai helyettesítik organikus.
Általában ez a fajta reakció alkánokkal és aromás szénhidrogénekkel (benzol és származékai) megy végbe.
A halogénezést azért hívják, mert a halogének egyszerű anyagainál fordul elő: F2Cl2, br2 Hé2. Ezek közül azonban a leggyakoribb a klórozás (Cl2) és brómozás (Br2), mivel a fluor nagyon reaktív, reakciói robbanékonyak és nehezen szabályozhatók, még a szerves anyagokat is elpusztítják:
CH4. g) + 2 F2. g) → Cs + 4HFg)
A jóddal történő reakció rendkívül lassú.
Az alábbiakban bemutatjuk a halogénezés fő típusait és néhány példát:
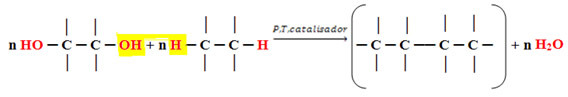
1. Halogénezés alkánokkal: Mivel az alkánok gyengén reagálnak, halogénezési reakcióik csak napfény (λ), ultraibolya fény vagy erős melegítés esetén mennek végbe. Ez a fajta reakció egy alkil-halogenid előállítására szolgál.
Példa: metán monoklórozás:

Ebben az esetben a metán (CH
4) helyébe klóratom lép, monoklór-metánt kapva. Ha túl sok a klór, akkor ez a reakció folytatódhat, a metánban lévő összes hidrogén helyettesítésével.1.1. Halogénezés 3-nál több szénatomot tartalmazó alkánokban: Ha a reagálni kívánt alkán legalább 3 szénatomot tartalmaz, akkor különböző szubsztituált vegyületek keverékével végzünk. Lásd az alábbi példát a metil-bután monoklorinról:
Ne álljon meg most... A reklám után még több van;)

Az egyes vegyületek mennyisége arányos lesz a következő sorrenddel, amellyel a hidrogén felszabadul a molekulába:

Így a fenti esetben a legnagyobb mennyiség 2-metil-2-klór-bután, a legkisebb mennyiség pedig 2-metil-1-klór-bután lesz.
2. Benzol-halogénezés: A benzol általában nem reagál klórral vagy brómmal. Ha azonban Lewis-savat használunk katalizátorként (általában FeCl-ot használunk)3, FeBr3 vagy AlCl3, mind vízmentes formában), a benzol halogénezési reakcióban könnyen reagál.
A kloridot és a vas-bromidot úgy lehet előállítani, hogy csak hozzáadják a vasat a keverékhez, és így reagál a halogénnel és előállítja a Lewis-savat:
2 Fe + 3 Br2 → 2 FeBr3
Lásd a benzol halogénezésének és mechanizmusának példáját:

3. Benzolszármazékok halogénezése:Ilyen esetekben a szubsztitúciót az aromás maghoz kapcsolódó szubsztituens vagy funkcionális csoport vezérli. Olvassa el a szövegeket, hogy lássa, hogyan történik ezRadikálisok kormányzása a benzolgyűrűben"és"A meta és az orto-to-rendezők radikálisainak elektronikus hatásai”.
Írta: Jennifer Fogaça
Kémia szakon végzett
Hivatkozni szeretne erre a szövegre egy iskolai vagy tudományos munkában? Néz:
FOGAÇA, Jennifer Rocha Vargas. "Szerves halogénezési reakciók"; Brazil iskola. Elérhető: https://brasilescola.uol.com.br/quimica/reacoes-organicas-halogenacao.htm. Hozzáférés: 2021. június 28.