A Elektrokémia a fizikai kémia olyan ága, amely tanulmányozza azokat a reakciókat, amelyekben elektrontranszfer zajlik (oxi-redukciós reakciók) és annak reakcióit átalakítás elektromos energiává, valamint az ellenkező folyamat, vagyis az elektromos energia energiává történő átalakítása kémia.
Az első folyamat az, ami a Elemek. Az elemek két elektróda (egy pozitív pólus, amely a katód, és egy negatív pólus, amely az anód), valamint egy elektrolit (vezető oldat) által alkotott eszközök. Az elektronokat egy külső vezető továbbítja az anódtól a katódig, így elektromos áram képződik, amelyet valamilyen eszköz bekapcsolására használnak. Az elemek több cellából állnak, amelyek sorba vagy párhuzamosan vannak csatlakoztatva.
Ez egy spontán folyamat, és az energiaellátás addig folyik, amíg a kémiai reakció ki nem merül (mint az elsődleges cellák és elemek, például a Leclanché szárazelem és az akkumulátor esetében) alkáli), vagy reverzibilis reakciók esetén potenciálkülönbség alkalmazható és a reakció megfordítható, újra képezve a reagenseket és újratöltve az akkumulátort készen áll az újrafelhasználásra (ez az akkumulátorok és a másodlagos akkumulátorok, például az autókban használt ólom és a készülékekben használt lítium-ionok esetében mobiltelefonok).

Elsődleges cellák és elemek az előtérben, a másodikban pedig másodlagos elemek (ólom és lítiumion) újratöltése
Az inverz folyamat viszont nem spontán, és hívják elektrolízis. Az elektrolízis egy generátorból, például cellából vagy akkumulátorból érkező elektromos áram áthaladása ionos folyadékon keresztül. Ha a folyadék valamilyen olvadt anyag, akkor a magmás elektrolízis, de ha vizes oldat, akkor van egy vizes elektrolízis.
Amikor az elektromos áramot a folyékony közegen vezetik át, a generátor "kihúzza" az elektronokat a pozitív pólusból (anód - ez ellentétes a akkumulátort), és átviszi őket a negatív pólusba (katód), vagyis a katód redukción megy keresztül, az anód pedig oxidáció. Így a generátor által szolgáltatott elektromos energia átalakul redox reakciókká (kémiai energia). Az alábbiakban egy vízelektrolízissémát mutatunk be
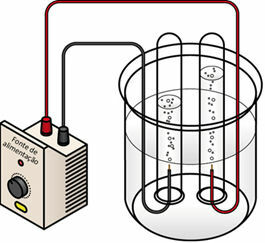
Vízelektrolízisséma
Az elektrolízist iparilag széles körben alkalmazzák fontos anyagok, például alumínium, klórgáz, fémes nátrium előállításában, valamint különféle fémek tisztítására vagy védelmére, mint a galvanizálási vagy galvanizálási eljárásoknál, amelyek során valamilyen tárgyat bevonnak egy fémmel, például ezüstözéssel, rézbevonással, nikkelezéssel, aranyozással és színezés; ha az acélt cinkkel vonják be, akkor horganyzásnak nevezik.
Szakaszában Elektrokémia weboldalunkon további részleteket talál a cellákkal és akkumulátorokkal, valamint az elektrolízissel kapcsolatos minden szempontról.
Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletroquimica.htm
