Savak olyan anyagok, amelyek vizes közegben ionizáljuk és jók vezetők erő. Az anyag savtartalma a hidrogénionos potenciál mérésének technikáival mérhető (pH) oldatát. Néhány pH-analitikai módszer olyan indikátorokat használ, mint a lakmusz vagy a fenolftalein, amelyek színben tükrözik az oldat pH-értékét.
A savak jellemezhetők:
oxigén jelenléte vagy hiánya a molekulájában;
erővel;
ionizálható hidrogénnel;
volatilitása által.
Olvassa el:Savak és bázisok összehasonlítása - különbségek és tulajdonságok
A savak jellemzői
Vizes közegben ionizálódnak, felszabadítva a H kationt+.
A villamos energia vezetői azok kibocsátása miatt ionok vizes közegben.
Az alapvető környezettel érintkezve szenvednek semlegesítési reakció, sót és vizet képezve ennek a reakciónak a termékei.
Megváltoztatják az oldat színét egy indikátor anyag, például lakmusz vagy fenolftalein jelenlétében.
A citrom, a narancs, többek között a citrusfélék savanyú ízét az ezekben az ételekben található sav okozza.
Hidrogénpotenciál (pH)
A hidrogénion-potenciál (pH) egy olyan számítás, amely kifejezi a
ionkoncentrációja hidrogén egy bizonyosban megoldás. A pH meghatározásához és a táptalaj elemzéséhez a következőket kell figyelembe venni:Ostwald hígítási törvénye (minél hígabb, annál több ion képződik az oldatban);
víz autoionizáció (Kw), amely a H molekula természetes lebomlása2O H-ionokban+ és ó-;
25 ° C-on desztillált víz autoionizációja Kw = 10-14 és azonos koncentrációjú H-ionok+ és ó-vagyis semleges közeg.
H-koncentrációval járó pH-számításhoz+, használat: pH = -log [H+].
Tudjuk, hogy:
pH> 7 → bázikus oldat
pH <7 → savas oldat
pH = 7 vagy pH = pOH → semleges oldat
Lásd még: Milyenek a savas tápszerek?

A savak osztályozása
A savosztályozás négy különböző szempont figyelembe vételével tehető meg.
Ionizációs fok (α) vagy saverősség
α = ionizált molekulák száma
oldott molekulák száma
Erős savak: α ≥ 50%.
Példa: ásav kénes (H2CSAK4) → α = 61%.Félig erős vagy mérsékelt savak: 5% < α < 50%.
Példa: foszforsav (H3POR4) → α = 27%.Gyenge savak: α ≤ 5%.
Példa: bórsav (H3BO3) → α = 0,075%.
→ Ionizálható hidrogén száma
monosav: H kationt szabadít fel+.
Példa: ásav sósav (HCL);
diszid: két H kationt szabadít fel+.
Példa: hidrogén-szulfid (H2S).Triacid: három H kationt szabadít fel+.
Példa: bórsav (H3BO3).tetracid: négy H kationt szabadít fel+.
Példa: pirofoszforsav (H4P2O7).
Figyelem! A hidrogénsavak esetében a molekulában található összes hidrogén ionizálható; de az oxisavak esetében csak az oxigénatomhoz kötött hidrogének ionizálhatók. Ilyen például a hipofoszforsav (H3POR2), amely monosav, mert annak ellenére, hogy összetételében három hidrogén van, csak a hidrogénhez szabadul fel, amely a oxigén.
→ Oxigén jelenléte
oxisavak: oxigén van a szerkezetükben.
Példa: hipoklorinsav (HO Cl).
Hidracidák: szerkezetükben nincs oxigén.
Példa: fluorsav (HF).
→ Volatilitás
Rögzített: forráspont(LÁB) > 100 ° C, lassan gázállapotba változik.
Példa: kénsav (H2CSAK4) → PE = 340 ° C.illékony anyagok: forráspont <100 ° C, gyorsan és könnyen gázállapotba változik.
Példa: hidrogén-szulfid (H2S) → PE = -59,6 ° C.
Sav-nómenklatúra
→ Hidracidok
Sav + anion neve + víz
Valamennyi sav esetében a „sav” kifejezést a molekulát jellemző nómenklatúra előtt használják. A sósavakban az elem nevének „eto” utótagja helyébe „hidric” lép.
Példák:
HCl → sav klórvízvezeték
HBr → sav brómvízvezeték
HF → sav fluorvízvezeték
→ oxisavak
Az oxisavak nómenklatúrája a oxidációs szám (NOX) a központi elem. Lásd az alábbi táblázatot:
A központi elem NOX-értéke |
Sav-nómenklatúra |
||
előtag- |
-szóbelseji formáns- |
-tag |
|
+1 és +2 |
Víziló- |
-anion neve- |
-oso |
+3 és +4 |
-- |
Anion neve- |
-oso |
+5 és +6 |
-- |
Anion neve- |
-ic |
+7 |
Per |
-anion neve- |
-ic |
Példák:
HClO → Annak ismeretében, hogy a hidrogénben (H) normál esetben NOX +1, az oxigénben (O) pedig NOX -2 van, ahhoz, hogy 0 töltésű molekulánk legyen, a klórnak (Cl) NOX +1 értékkel kell rendelkeznie, tehát ennek a savnak a nómenklatúrája hipoklorinsav.
HNO2 → salétromsav
HClO4 →ásavperklóros
→ Kivételek a szabály alól
H2CO3 → szénsav, és nem széntartalmú, mint a NOX-szabály szerint.
H3BO3 → ásav bóros, és nem unalmas.
Savak a mindennapi életben
Trágyák és gyógyszerek: Foszforsav (H3POR4) széles körben alkalmazzák műtrágyák gyártásában és gyógyszerként is. Ez egyike a gyógyszerek területén alkalmazott számos savnak.
Citrusfélék: van aszkorbinsav (C6H8O6), más néven C vitamin.
Ecet: van az összetételében Ecetsav (CH3COOH).
- Pezsgő és üdítők: szénsavból áll (H2CO3), amely frissítő érzetet ad a terméknek.
Hozzáférhet továbbá:A savak szerepe az üdítőkben

megoldott gyakorlatok
1. kérdés - (Enem) A vörös káposztából kivont gyümölcslé a különböző oldatok savjellegének (pH 0 és 7 között) vagy lúgos (7 és 14 közötti) mutatójának indikátoraként használható. Egy kevés káposztalé és az oldat összekeverésével a keverék savas vagy bázikus jellegének megfelelően az alábbi skálának megfelelően különböző színű kezd lenni.
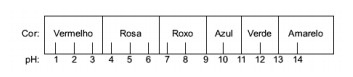
Néhány megoldást teszteltünk ezzel a mutatóval, és a következő eredményeket kaptuk:
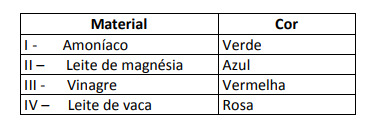
Ezen eredmények szerint az I., a II., A III. És a IV. Megoldás a következő karakterrel rendelkezik:
A) savas / bázikus / bázikus / savas.
B) sav / bázikus / sav / bázikus.
C) lúgos / savas / lúgos / savas.
D) sav / sav / bázikus / lúgos.
E) Bázikus / Bázikus / Sav / Sav.
Felbontás
E. alternatíva Annak megállapítására, hogy az anyag savas, lúgos vagy éppen semleges jellegű-e, elemzést kell végezni a teszt során kapott színeknek az adott skála adataihoz viszonyítva. Annak tudatában, hogy a pH = 7 oldatok semlegesek, a pH> 7 lúgosak és a pH <7 savak, eljutunk következtetés, hogy az ammónia és a magneziumtej alapvető anyag, az ecet és a tehéntej pedig savak.
2. kérdés - (PUC-Camp) A savaknak nevezett anyagokkal kapcsolatban egy hallgató a következő jellemzőket vette észre:
I - maró ereje van;
II - képesek bázisok semlegesítésére;
III - két kémiai elemből állnak;
IV - vizes oldatokat képez, amelyek elektromos áramot vezetnek.
CSAK ben hibázott
A) I. és II
B) I. és III
C) I. és IV
D) II és III
E) III. És IV
Felbontás
B. alternatíva Nem minden sav maró hatású, csak a legerősebbek, és a savak két vagy több atomból állhatnak.
írta Laysa Bernardes
Kémia tanár
