A sejtek vagy elektrokémiai cellák és akkumulátorok olyan eszközök, amelyekben a kémiai energia spontán átalakul elektromos energiává.A cella csak két elektródából és egy elektrolitból áll, míg az akkumulátor soros vagy párhuzamos elemkészlet.
Nál nél az elsődleges elemek nem újratölthető eszközökmivel a bennük bekövetkező oxidációs-redukciós reakció megszűnik, el kell dobni.
Minden berendezésnél feltüntetik az akkumulátor típusát, és a jelenleg használt elsődleges elemek közül a legfontosabbak: Leclanché száraz cellák (közönséges elemek vagy savas cellák), alkáli elemek és lítium / mangán-dioxid elemek.
Nézze meg, mi különbözteti meg őket és milyen felszerelésre alkalmasak:
- Leclanché száraz sejtek:
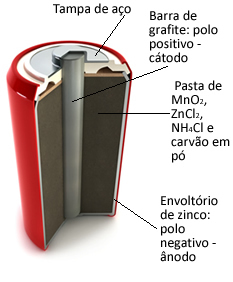
Ezeket a cölöpöket alapvetően egy cinkburkolat alkotja, amelyet porózus papír és egy mangán-dioxiddal (MnO2), szénpor (C) és ammónium-kloridot (NH4Cl), cink-klorid (ZnCl2) és a víz (H2O).
O cink- úgy működik, mint a anódelektronok elvesztése; ez a grafit úgy működik, mint a katód-, amely elektronokat vezet a mangán-dioxidhoz:
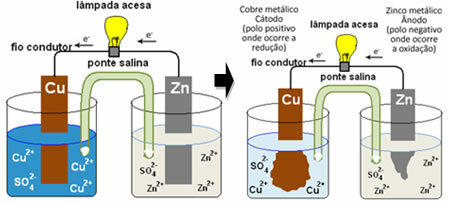
Anód félreakció: Zn s → Zn2+(itt) + 2 és-
Katód félreakció: 2 MnO2 (aq) + 2 NH41+(itt) + 2e- → 1 Mn2O3s + 2NH3. g) + 1 óra2O(1)
Globális reakció: Zn s + 2 MnO2 (aq) + 2 NH41+(itt) → Zn2+(itt) + 1 Mn2O3 (s) + 2NH3. g)
Ez az akkumulátortípus könnyű és folyamatos kisütést igénylő berendezésekhez, például távirányítóhoz, faliórához, hordozható rádióhoz és játékokhoz alkalmas.
További információkat az eredetükről, működésükről, tartósságukról, ddp-jükről, veszélyekről és óvintézkedésekről olvashatunk a következő szövegben:Leclanché száraz verem”.
Ne álljon meg most... A reklám után még több van;)
- Alcaline elemek:
Működése nagyon hasonlít a Leclanché száraz sejtjeihez, azonban az egyetlen különbség az, hogy a klorid helyett ammóniumot (amely savas só), erős bázist adunk hozzá, főleg nátrium-hidroxidot (NaOH) vagy kálium-hidroxidot (KOH).
Anód félreakció: Zn + 2 OH → ZnO + H2O + 2e-
Katód félreakció: 2 MnO2 + H2O + 2e-→ Mn2O3 + 2 OH
Általános reakció: Zn +2 MnO2→ ZnO + Mn 2O3

Az alkáli elemek előnyösebbek, mint a savasak, abban az értelemben, hogy nagyobb az élettartamuk általában 50-100% -kal több energiát szolgáltat, mint egy azonos méretű, szokásos akkumulátor, ráadásul kisebb a veszélye szivárog.
Elsősorban olyan eszközökre vonatkoznak, amelyek gyors és intenzívebb letöltést igényelnek, például rádiók, hordozható CD / DVD és MP3 lejátszók, elemlámpák, digitális fényképezőgépek stb.
Olvassa el a szöveget is Alcaline elemek.
- Lítium / mangán-dioxid elemek:
Ezek az akkumulátorok könnyűek és nagy (kb. 3,4 V) feszültséget generálnak, ezért gyakran használják olyan kis berendezésekben, mint például az órák és a számológépek. A korábbi esetekkel ellentétben formátuma pénznem, amint az a következő képen látható:

Az anód lítium, a katód mangán-dioxid és az elektrolit sóoldat:
Anód félreakció: olvas →olvas+ + és−
Katód félreakció: MnO2 + olvasni+ + és−→MnO2li)
Általános reakció: Li + MnO2 → MnO2li)
Írta: Jennifer Fogaça
Kémia szakon végzett
Hivatkozna erre a szövegre egy iskolai vagy tudományos munkában? Néz:
FOGAÇA, Jennifer Rocha Vargas. "A leggyakoribb sejttípusok és elsődleges elemek"; Brazil iskola. Elérhető: https://brasilescola.uol.com.br/quimica/tipos-pilhas-baterias-primarias-mais-comuns.htm. Hozzáférés: 2021. június 27.