Minden sejt olyan eszköz, amelyben spontán oxidációs-redukciós reakció lép fel, amely elektromos áramot generál, amelyet viszont néhány berendezés működésére használnak.
Ezek az eszközök azért kapták a nevüket, mert az első létrehozott akkumulátort Alessandro találta fel Még 1800-ban cink- és rézkorongok alkották, amelyeket beáztatott pamut választott el sóoldat. Ezt a szettet metszve helyezték egymás tetejére, felhalmozódik a korongokat és egy nagy oszlopot képeznek. Milyen volt a akkumulátor lemezekről kezdték nevezni ezen a néven.

Az elemek mindig két elektródából és egy elektrolitból állnak. A pozitív elektródát a katód- és itt reagál a csökkentés. A negatív elektróda az anód és itt reagál a oxidáció. Az elektrolitot is hívják sóhíd és az ionvezető oldat.
Annak megértéséhez, hogy ez hogyan generál elektromos áramot, olvassa el az egyik első akkumulátor, a Daniell halma, amelyben egy tartály volt réz-szulfát oldattal (CuSO4 (aq)) és ebbe az oldatba mártva rézlemez volt. Egy másik külön tartályban cink-szulfát (ZnSO
4 (aq)) és mártott cinklemez. A két oldatot sóhíd kötötte össze, amely üvegcső volt kálium-szulfát oldattal (K2CSAK4 (aq)) üveggyapottal a végén. Végül a két lemezt egy külső áramkör kapcsolta össze egy lámpával, amelynek világítása jelezné az elektromos áram áthaladását: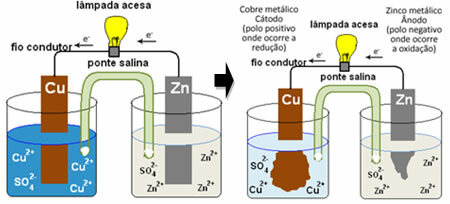
Az történik, hogy a cink nagyobb mértékben hajlamos az oxidációra, vagyis az elektronok elvesztésére, így a penge fém cinkje negatív elektródként, anódként működik, ahol oxidáció történik: Zns ↔ Zn2+(itt) + 2 és-. A cink által elvesztett elektronokat a külső áramkör a rézbe szállítja, így létrehozva az elektromos áramot, amely bekapcsolja a lámpát. Az oldat rézionjai elektronokat fogadnak (redukálódnak) és átalakulnak fémrézzé, amely a rézlemezre rakódik le. Ez azt jelenti, hogy ez a pozitív elektróda, katód, ahol a redukció bekövetkezik: Szamár2+(itt) + 2 és- ↔ szamárs.
Ne álljon meg most... A reklám után még több van;)
A mai akkumulátorok működési elve ugyanaz, amikor az egyik fém vezetőképes megoldáson keresztül elektronokat adományoz a másiknak, és elektromos áram keletkezik. A különbség az, hogy a manapság használt akkumulátorok szárazak, mert nem folyékony oldatot használnak elektrolitként, amint az Daniell akkumulátorában előfordul.
Ma nagyon sokféle akkumulátor létezik, amelyeket kereskedelmi forgalomban értékesítenek. Közülük a leggyakoribbak a savsejtek (Leclanché-ból) és aalkalin elemek.
Mindkettő cink negatív elektródja; másrészt pozitív pólusként a mangán-dioxiddal (MnO2), porított szén (C) és nedves paszta. A különbség az, hogy a savas halomban ammónium-kloridot (NH) használnak a nedves pasztában.4Cl) és cink-klorid (ZnCl2) - savas sók - a víz mellett (H2O). Az alkáli elemben kálium-hidroxidot (KOH) használnak, amely bázis.

A Leclanché akkumulátorok a legalkalmasabbak a könnyű és folyamatos kisütést igénylő berendezésekhez, például távirányítóhoz, faliórához, hordozható rádióhoz és játékokhoz. Az alkáli elemeknek viszont 50–100% -kal több energiájuk van, mint egy ugyanolyan méretű közös elemnek. gyorsabb és intenzívebb letöltéseket igényelnek, például rádiókat, CD / DVD-lejátszókat, hordozható MP3-lejátszókat, elemlámpákat, digitális fényképezőgépeket stb.

Tudjon meg többet arról, hogy milyen elektrolitokat és elektródákat használnak ezekben és más típusú elemekben is. hogy milyen típusú berendezésekre ajánlott a legjobban, olvassa el a kapcsolódó cikkeket ordít.
Írta: Jennifer Fogaça
Kémia szakon végzett
