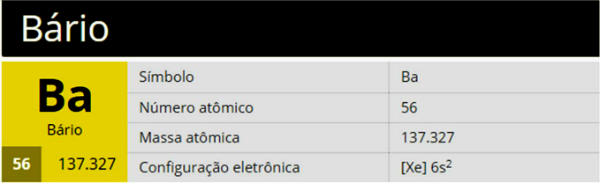
A bárium egy Ba szimbólumú, 56-os számú és 137 327 atomsúlyú kémiai elem, amely a periódusos rendszer 2. csoportjába (2A család) tartozik, alkáliföldfém.
Neve a görögből származik barys és ez nehéz.
Jellemzők
Szobahőmérsékleten szilárd állapotban, lágy állagú és ezüstös színű. A természetben azonban nem található meg tiszta formájában, mivel a levegővel érintkezve könnyen oxidálódik.
A bárium a baritércekben található (BaSO4) és witerit (BaCO3). Ezen ércek fő bányaterületei az Egyesült Királyságban, Olaszországban, Csehországban, az Egyesült Államokban és Németországban találhatók.
A bárium olvadáspontja magas (1000 K - 727 ° C) és forráspontja (2170 K - 1897 ° C). Még mindig jó áramvezető.
Vízzel és alkohollal érintkezve nagyon reakcióképes. Vízzel történő reakciója hidroxidot eredményez és felszabadul hidrogén.
Az oldható báriumvegyületek mérgezőek a szervezetre. Annak ellenére, hogy a vízben és az ételekben megtalálható, a jelenlévő bárium mennyisége nem elegendő az egészségügyi problémák előidézéséhez.
Magas oxidáló ereje miatt a báriumot tartósítani kell ásványolajban.
Tudjon meg többet, olvassa el még:
- Kémiai elemek
- Periódusos táblázat
alkalmazások
A bárium fő alkalmazásai közé tartoznak:
- Tiszta formájában oxigén eltávolítására használják az elektronikus szelepekből;
- Patkányméreg bárium-karbonát formájában;
- Fehér pigmentként használják a festékekben;
- Üveggyártás;
- A bárium-szulfátot folyadékként használják olaj- és gázkutak fúrásához;
- A bárium-klorátot és a nitrátot pirotechnikai fáklyákban zöld lángok előállításához használják;
- A bárium-szulfid fokozza a kontrasztot az emésztőrendszer röntgenvizsgálatánál, és szájon át adják a betegeknek. A lenyelés nem okoz egészségügyi problémákat, mivel az anyag oldhatatlan, nem halmozódik fel és gyorsan kiürül a szervezetből;
Míg a bárium-szulfid ártalmatlan, a bárium-karbonát rendkívül mérgező és végzetes lehet. A mérgezett személynek légzési nehézségei vannak, hányása, remegése, tachycardia, megnövekedett vérnyomás és nyálképzés.
Ön is érdekelheti:
- Fém linkek
- Réz
- Lítium

