Mivel több ezer szerves vegyület létezik, az izomerizmus jelensége többféle formát ölthet. Ezért az izomerizmus alapvetően két típusba sorolható: lapos vagy alkotmányos izomerizmus és térizomerizmus vagy sztereoizomerizmus. Minden említett típust fel lehet osztani, az alábbi ábra szerint:
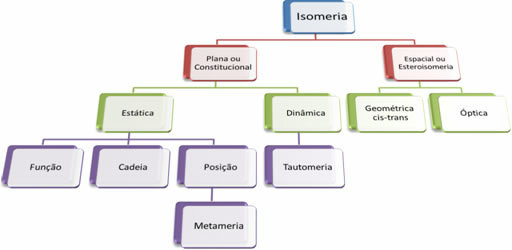
Lásd minden esetet:
1. Lapos vagy alkotmányos izomerizmus: Az ilyen típusú izomerek molekuláris képlete azonos és lapos szerkezeti képletek különböztetik meg őket. A sík izomerizmusnak öt esete van: funkció, lánc, helyzet, metamerizmus és tautomerizmus.
1.1.Funkcionális vagy funkcionális izomerizmus: Az izomerek közötti különbség a funkcionális csoportban van.
Példa: C molekulaképlet3H6O
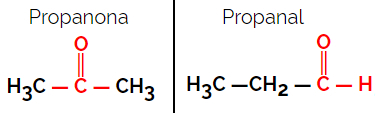
Vegye figyelembe, hogy a propanon a ketoncsoportba, a propanal pedig az aldehidcsoportba tartozik.
1.2. Lánc vagy csontváz izomerek: Az izomerek közötti különbség a lánc típusában van. Például az egyik izomer nyílt láncú, a másik zárt láncú, vagy az egyik normál és a másik elágazó láncú, vagy az egyik homogén lánc, a másik pedig heterogén lánc.
Példa: C molekulaképlet4H10
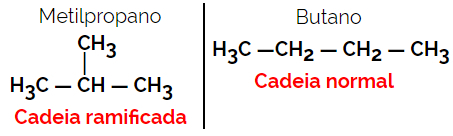
1.3.Pozíciós vagy helyzetbeli izomerizmus: A különbség a telítetlenség, a funkcionális csoport, a heteroatom vagy a szubsztituens helyzetében van.
Példa: C molekulaképlet4H6

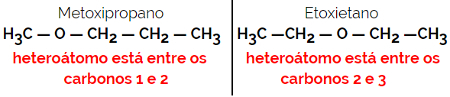
1.4.Kompenzációs izomerizmus vagy metaméria: Ez egy speciális típusú helyzetizomerizmus, ahol a különbség a heteroatom helyzete.
Példa: C molekulaképlet4H10O
1.5.Dinamikus izoméria vagy tautoméria: A funkció izomerizmus egy speciális típusa, amelyben az izomerek oldatban dinamikus egyensúlyban vannak. A tautomeria két fő típusa egy keton és egy enol (ketoenol-egyensúly), valamint egy aldehid és egy enol (aldoenol-egyensúly) között van.
Példa: C molekulaképlet3H6O
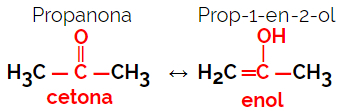
2. Térizomerizmus vagy szteroizomerizmus: Ebben az esetben az izomerek közötti különbség csak atomjaik térbeli orientációján keresztül jeleníthető meg. A sztereoizomerizmusnak két típusa van: a geometriai és az optikai izomerizmus.
2.1.Geometriai vagy cisz-transz izomerek: A különbség az, hogy az izomer nevű cisz kettős kötésben vagy a sík ugyanazon oldalán található ciklikus vegyületekben ugyanazok a szénszalagok vannak. Az izomer ligandumok ford ellentétes oldalon vannak.
Példa: C molekulaképlet2H2Cl2

Ezeket a vegyületeket ún sztereoizomerek.
2.2.Optikai izomer: Akkor fordul elő, amikor az izomerek képesek eltéríteni a polarizált fénysugarat. Ha a polarizált fénysugarat balra hajlítja, akkor levorotáris izomer, de ha jobbra hajlik, jobbkezes izomernek nevezzük.
Példa:
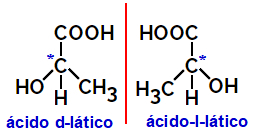
A fentiekhez hasonló aszimmetrikus molekulákat, amelyek egymás tükörképei és nem egymásra helyezhetők, ún. enantiomerek.
Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/tipos-isomeria.htm
