az entrópia egy nagyságtermodinamika társult, összekapcsolt, társított valamivel visszafordíthatatlanság fizikai rendszer állapotainak. Általában a "rendellenességVagy „véletlenszerűségEgy rendszer. Az egyik állítása szerint A termodinamika 2. törvénye:
“Hőszigetelt rendszerben az entrópia mérésének mindig növekednie kell az idő múlásával, amíg el nem éri a maximális értéket. ”
Más szavakkal, a entrópia képes mérni a "az idő nyilaEgy rendszer. Amikor meglátjuk az alábbi képeket, intuitív módon tudjuk, hogy a rendszer kezdeti állapotát a bal, a legnagyobbak közül szervezet:
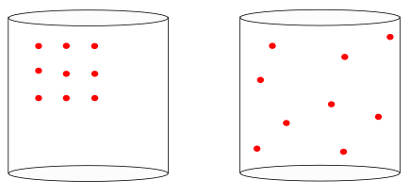
Az előző képet nézve tudjuk, hogy a legvalószínűbb az a konfiguráció, amelyben az atomok vannak sebesség minden irányban, továbbá véletlenszerű pozíciók. Erről szól az entrópia: a sokaság egy rendszer állapotainak mindig növekednie kell.
Példák
Az alábbi beállítások közül melyik valószínűbb téglák elrendezése során figyelni kell az idő múlásával?

Az első konfigurációban a sokaság a blokkok állapota az kis: mindegyik a irány
vízszintes, párhuzamos egymás. Az idő múlásával vagy egy ügynök tevékenységével várható, hogy konfigurációja felnő ban ben szám ban ben Államok, előnyben részesítve a hétfőkonformáció, amelyet a jobb oldali kép szemléltet. További példák adhatók:Amikor egy jégcsomagot egy tartályba helyezünk nagyobbhőfok, hőmérséklete addig nő, amíg el nem éri a hőmérleg. Ekkor a jég megolvadhat. Azzal, hogy újból hőt vesz a jégtömbből, amely most állapotban van folyékony, újra szilárdtá válhat, de konformitása nem lesz ugyanaz a szervezete hogy korábban bemutatták.
Egy üveg parfüm kinyitásakor a hő segíthet diffúzió a tiéd molekulák, elosztva a parfüm tartalmát a szoba teljes hosszában. Ennek ellenkezője nem várható, mivel a hő eltávolítása nem segítené a molekulák visszatérését a lombikba.
Az entrópia matematikai meghatározása
A matematikai meghatározás Az entrópiát a hőmennyiség aránya adja meg (Q) egy hőszigetelt rendszer két része között, in joule (J) abszolút hőmérséklete szerint, Kelvin (K):

S = Entrópia (J / K)
ΔQ = Hőmennyiség (J)
T = Abszolút hőmérséklet (K)
A fenti meghatározás a következőre érvényes: izoterm folyamatokvagyis olyan kicsi (vagy lassú) hőcserék vannak, amelyek nem képesek megváltoztatni a rendszer hőmérsékletét. Az entrópia meghatározása tehát elenyésző (végtelenül kis rész).
Az entrópia fogalmát a következőképpen is megérthetjük: ugyanazon gáz két részéből kialakított rendszerről van szó sok különbözőhőmérsékletek, lehetséges kivonni bizonyos mennyiségű munka hogy néhányat megmozgat dugattyú vagy kézi hajtókar, például. Azonban, túlóra, ennek a gáznak a részei hajlamosak lesznek egyensúlytermikus. Ha már nincs különbség a hőmérsékletben, még akkor sem, ha az összes energia jelen van, akkor nem lehet kinyerni semmit munkahasznos tőle.
Rafael Hellerbrock
Fizikából végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-entropia.htm

