Bázis van szervetlen anyag amely a svéd vegyész szerint Svante Arrhenius, ha vízbe helyezzük, szenved a jelenség ionos disszociáció, amelyben a ionok: kation (Y+) és hidroxid-anion (OH-).

Arrhenius-bázis általános képlete
a Y csoportja bázis lehet bármely fém vagy az ammóniumcsoport (NH4+), amelyek a disszociáció során kationként szabadulnak fel a vízben, amint az a folyamatot ábrázoló egyenletben is látható:
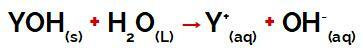
Egy bázis disszociációját képviselő egyenlet
Lásd az alábbiakban néhány nagyon fontos információt a. Osztályozásáról és nómenklatúrájáról bázisok.
1) Osztályozás a bázisok oldhatósága(képesség valamire feloldani a vízben)
Alapok oldódó: alkálifém vagy ammónium van a készítményben;
Alapok mérsékelten oldódik: van alkáliföldfém összetételében. Példa: magnézium-hidroxid, amelyet savkötőként és hashajtóként széles körben alkalmaznak;
bázisok gyakorlatilag oldhatatlan: bármilyen más fém van a kompozícióban. Példa: alumínium-hidroxid, amelyet savkötőként széles körben alkalmaznak.
2) Osztályozás a helyi erő(képesség valamire elhatárolódni a vízben)
Alapok erős: alkáli- vagy alkáliföldfémek vannak a készítményben, a magnézium kivételével;
Alapok gyenge: bármilyen más fém van a kompozícióban.
3) Alapnómenklatúra
Egy bázis megnevezéséhez kövesse az alábbi elnevezési szabályt:
Hidroxid + de + fém vagy ammónium neve
Példa: Ca (OH)2 → kalcium-hidroxid
Ha az alapnak van olyan kémiai eleme, amely nem tartozik az IA, IIA vagy IIIA családokba (és ez nem az ezüst vagy cink), az elem neve előtt, római számokkal kell feltüntetnünk a számot hidroxilok:
Példa: Ti (OH)4 → titán-hidroxid IV
Általam. Diogo Lopes
Forrás: Brazil iskola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-base.htm
