kettős só a név annak az osztályozásnak, amelyet a szervetlen sók kaphat. A többi osztályozás: egyszerű, timsó, hidroxilezett, hidrogénezett és hidratált. Kettős sónak minősítéséhez egy szervetlen sónak az alábbiakban leírt kombinációk egyikével kell rendelkeznie:
Egy kation (Y) és bármely két anion (X és W), amelyet a következő képlet képvisel:
YXW
Egy anion (X) és bármely két kation (Y és Z), és a következő képlet képviseli:
YZX
Jegyzet: Ezek a sók akkor képződnek, amikor a semlegesítési reakció kettő között végezzük bázisok más és egy sav, vagy két különböző sav és egy bázis között.
A kettős só elnevezési szabálya
Megnevezni a kettős só, először is meg kell ismerni annak felépítését, mert a kettős só minden típusához külön névadási szabály vonatkozik, amint az alább látható:
a) Nómenklatúra-szabály két kationos kettős sóra
Amikor egy kettős só két kation van, a következő szabályt kell használnunk:

Nómenklatúra-szabály két kationos kettős sókra
Az alábbiakban két példát találunk ennek a névadási szabálynak az alkalmazására:
1. példa: Vonal4s
Ez a só a következőkből áll:
Anion: szulfid (S-2);
Több elektropozitív kation: lítium (Li+1);
Kevesebb elektropozitív kation: ammónium (NH4+1).
Ezért neve lítium (dupla) ammónium-szulfid.
2. példa: RbCaBO3
Ez a só a következőkből áll:
Anion: borát (BO3-3);
Több elektropozitív kation: rubídium (Rb+1);
Kevesebb elektropozitív kation: kalcium (Ca+2).
Így neve borát (kettős) rubídium és kalcium.
b) Nómenklatúra szabály a két anionos kettős sóra
Amikor egy kettős só két anionja van, a következő szabályt kell használnunk:
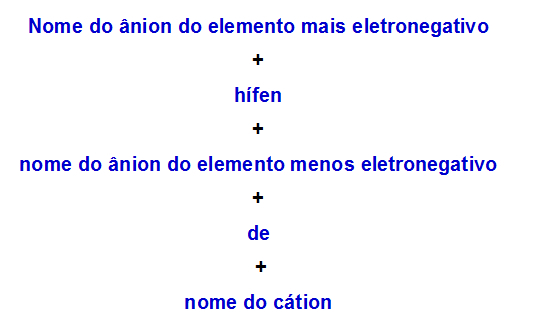
Nómenklatúra szabály, amelyet két anionos kettős sókra használnak
Íme két példa a szabály alkalmazására:
1. példa: MgFI
Ez a só a következőkből áll:
Kation: magnézium (Mg+2);
A legtöbb elektronegatív anion: fluorid (F-1);
Kevesebb elektronegatív anion: jodid (I-1).
Ezért neve magnézium-fluorid-jodid.
2. példa: ZnNO2br
Ez a só a következőkből áll:
Kation: cink (Zn+2);
Több elektronegatív anion: nitrit (NO2-1);
Kevesebb elektronegatív anion: bromid (Br-1).
Ezért neve cink-nitrit-bromid.
A kettős só képletének összeállítása a nómenklatúrájából
a) Két kationos kettős sóhoz
Az a képlet felépítése kettős só a nevének ismeretétől függ, amely szabványosított, mint az összes sóban, vagyis először a kation, majd az anion. Mivel a kettős sónak két kationja lehet, sorrendjük és elhelyezkedésük a képletben az adott nevet követi.
1. példa: bárium-nikkel-pirofoszfát II
Ez a só foszfátot (P2O7), bárium (Ba+2) és nikkel II (Ni+2), az ebben a sorrendben írt kationok. Tehát képlete BaNiP2O7.
2. példa: réz II-foszfát és arany I
Ennek a sónak foszfátja van (PO4-3), réz II (Cu+2) és arany I (Au+1), az ebben a sorrendben írt kationok. Ezért képlete CuAuPO4.
b) Két anionos kettős sóhoz
Esetében kettős só két anionnál azt is követjük, amikor az anionokat a képletbe helyezzük, az adott névben megjelenő sorrendet.
1. példa: nikkel-szulfát-jodid III
Ennek a sónak szulfátanionjai vannak (SO4-2) és jodid (I-1), és ebben a sorrendben írva a nikkel III kation (Ni+3). Tehát képlete NiSO4ÉN.
2. példa: ólom-cianid-foszfát IV
Ennek a sónak foszfátanionjai vannak (PO4-3) és cianid (CN-1), ebben a sorrendben írva, és a IV ólomkation (Pb+4). Tehát képlete a PbPO4CN.
Általam. Diogo Lopes Dias
Forrás: Brazil iskola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-sal-duplo.htm