A reakció dinamikus egyensúlya vagy kémiai egyensúlya akkor következik be, amikor az előre- és a fordított reakció egyidejűleg történik. Ezeket az úgynevezett reverzibilis rendszereket mindkét irányban nyilak jelzik:  vagy
vagy  . A reverzibilis reakcióra példa a fenti képen, a jódgáz és a hidrogéngáz között.
. A reverzibilis reakcióra példa a fenti képen, a jódgáz és a hidrogéngáz között.
A reakció kezdetén a reagensek mennyisége maximális, a termékeké pedig nulla. A reagensek azonban reagálnak egymással, csökkentve azok koncentrációját és növelve a képződött termékek koncentrációját. A közvetlen reakció fejlődési sebessége is csökken.
A termékek koncentrációjának növekedésével megindul az inverz reakció, és a reaktánsok újra képződnek; növekszik az inverz reakció kialakulásának sebessége is.
A kémiai egyensúly elérésekor, állandó hőmérsékleten, az előre- és a fordított reakció kifejlődésének sebessége azonos.
Mindenközvetlen = Minden fordított
Az árak megegyeznek, de a koncentrációk nem. A reagensek és a termékek koncentrációja valószínűleg nem azonos. Csak ritka esetekben fordul elő ez. A legtöbb esetben a reagensek koncentrációja magasabb lesz, mint a termékeké, vagy fordítva.
Így három lehetséges módszerünk van a - közvetlen és inverz reakciók, amelyek összefüggenek a reagensek és a termékek koncentrációjával a idő. Nézzük meg az egyes eseteket:
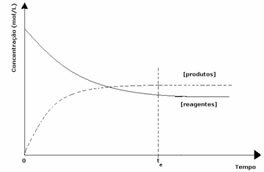
1. eset: Egyenlő koncentrációk:
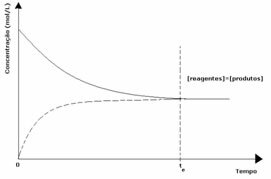
Amint a grafikonon látható, a t időpontbanés az előre- és a fordított reakció megegyezik, ebben az esetben a reagensek és a termékek koncentrációi megegyeznek. Így az egyensúly nem tolódik el egyik oldalra sem, mindkét reakció intenzitása megegyezik az alábbiakkal:
2. eset: A termékek koncentrációjánál nagyobb reagenskoncentráció:
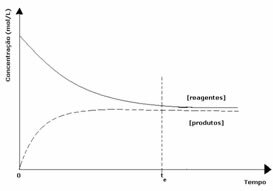
Ebben az esetben megfigyelhető, hogy az egyensúly elérésekor a reagensek koncentrációja nagyobb, mint a termékeké. Így arra a következtetésre jutunk, hogy ha több reaktáns van, akkor az inverz reakció nagyobb intenzitással megy végbe. A reakció balra tolódik:
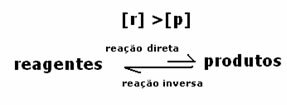
3. eset: A reagenseknél nagyobb termékkoncentráció:
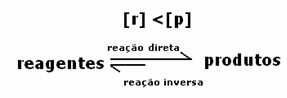
Mivel egyensúlyban a termékek koncentrációja nagyobb, ez azt jelenti, hogy a reakció igen jobbra tolódott, mert a közvetlen reakció (termékek képződésével) nagyobb intenzitás.
Mi jelzi, hogy a reakció jobbra vagy balra hajlik-e, az a K egyensúlyi állandó lesz, amely csak a hőmérséklettől függ.
Írta: Jennifer Fogaça
Kémia szakon végzett
Brazil iskolai csapat
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm