A víz elektrolízise abból áll, hogy ezt az anyagot elektromos áram útján lebontják és elektrolitot adnak hozzá. Értsük meg jobban, hogy történik ez?
Olvasd el te is: Mi az elektrolízis?
Hogyan történik a vízelektrolízis?
A vízmolekulák képesek önionizálódásra, H-ionok létrehozására+ (vagy H3O+) és ó-:
H2O ↔ H+ + OH-
vagy
2 óra2O ↔ H3O+ + OH-
Azonban, a víz nagyon gyenge elektrolit és hiába vannak ezek az ionok, nem tud vezetni elektromos áram. Tehát annak elektrolízisének, azaz elektromos áram általi lebontásának elvégzéséhez elektrolitot, ionos oldott anyagot kell adni, amely lehet só, bázis vagy sav.

A szelektív mentesítés elsőbbségi sorrendje
A szövegben kifejtettek szerint azonban Vizes elektrolízis, ebben az esetben nem csak a vízből származó ionok lesznek, hanem a benne oldott anyagé is. Az elektrolízis során az elektródon csak egy kation és egy anion ürül ki, vagyis egy elsőbbségi sorrendet követő szelektív mentesítés.
Ezért ahhoz, hogy a kisülendő katód és anód a vízé legyen, és ne az oldott anyagé, meg kell választani egy
sav, bázis vagy só, amelynek ionjai kevésbé könnyedén ürülnek ki az elektródákból, mint a vízben lévő ionok. Ehhez meg kell vizsgálnunk az alább látható kiemelt várólistát: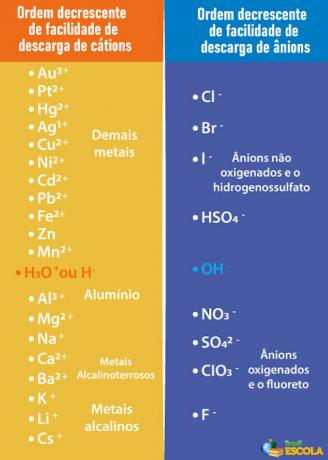
Vegye figyelembe, hogy a H alatt felsorolt kationok+ kevésbé könnyű kirakni, mint neki. A jobb oldali táblázatban azt látjuk, hogy az OH alatti anionok- kevésbé könnyű a kirakodás. Ezért választhatunk például sót, bázist vagy savat, amely a Na-ionokat képezi.+, K+, AT3-, CSAK42- és így tovább, amellett, hogy ugyanazokat az ionokat képezi, mint a víz, vagyis a H+ és ó-. Néhány példa: kénsav (H2CSAK4), nátrium-hidroxid (NaOH) és kálium-nitrát (KNO3).
Példa a víz elektrolízisében bekövetkezett reakciókra
Tegyük fel, hogy a víz elektrolízisét kénsav hozzáadásával hajtják végre. Ebben az esetben a következő ionok képződnek majd a közepén:
Sav disszociáció: 1 H2CSAK4 → 2 H+ + 1 SO42-
A víz autoionizálása: H2O → H+ + OH- vagy 2 óra2O → H3O+ + OH-
Vegye figyelembe, hogy az egyetlen létező kation a H.+, tehát ő szenvedi el a csökkenést (a elektronok) negatív elektródon (katódon) és hidrogéngázt fog termelniO (H2).
Ha az anionokról beszélünk, középen két anion található, amelyek az operációs rendszer42- és az ó-. Amint a fenti táblázat mutatja, az operációs rendszer42- reaktívabb és kevésbé könnyen üríthető. Így az OH- kisül, oxidálódik (elektronokat veszít) a pozitív elektródban (anód) és gázt fog termelni oxigén(O2):
Katód félreakció: 4 H3O+ + 4 és- → H2O + H2
Anód félreakció: 4 OH- → 2 H2O + 1 O2 + 4 és-
Összeadva ezt a folyamatot, elérjük a globális egyenletet:
Vízionizáció: 8 H2O → 4H3O+ + 4 OH-
Katód félreakció: 4 H3O+ + 4 és- → 4 H2O + 2H2
Anód félreakció: 4 OH- → 2 H2O + 1 O2 + 4 és-
Globális egyenlet: 2H2O → 2H2 + 1 O2
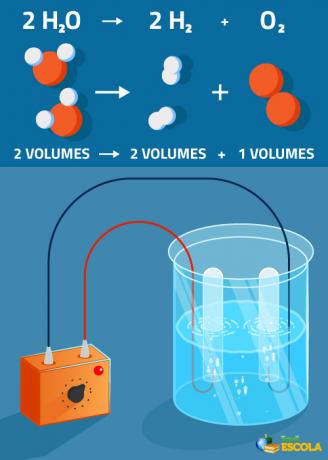
Vegye figyelembe, hogy a termelt hidrogén térfogata kétszer akkora, mint az oxigéné. A gyakorlatban azonban ezt a szigorú arányt nem ellenőrzik, mert az oxigén jobban oldódik, mint a gáz hidrogén.
Olvassa el: Alumínium megszerzése elektrolízissel
A vízelektrolízis alkalmazásai
A víz elektrolízise nagyon fontos folyamat, tekintve, hogy a hidrogén üzemanyagként felhasználható gáz. Mint a kőolaj eredetű üzemanyagok nem megújuló, a hidrogéngáz fontos alternatívává válhat.
Ezenkívül léteznek már olyan benzingyártási módszerek, amelyek a vízelektrolízis folyamatát használják. Nézze meg, hogyan történik ez a szövegben A tudósok képesek átalakítani a szén-dioxidot benzinné.
Írta: Jennifer Fogaça
Kémia tanár
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/eletrolise-agua.htm
