AZ entalpia egy termodinamikai függvény, amellyel kiszámítja az izobár folyamatokban részt vevő hőt, vagyis amelyek állandó nyomás alatt vannak. Kialakulására röviddel a kalóriaelmélet bukása után került sor, a termodinamika 1840 és 1850 között.
Az entalpia, a mitumica, nem sok értelme van, ha abszolút és elszigetelt értékként dolgozzuk fel, de igen, ha figyelembe vesszük a értékének változása kémiai folyamatban. Egy folyamat entalpiaváltozásának kiszámítására többféle módszer létezik, amelyek közül a legfontosabbak a képződési, kötési energiák és a ottszia hesstől.
Olvasd el te is: Mi az a Gibbs Free Energy?
Entalpia összefoglaló
Az entalpia egy termodinamikai eszköz az állandó nyomáson végbemenő folyamatok hőjének kiszámítására.
Ezt Josiah W. amerikai fizikus határozta meg. Gibbs, a kalóriaelmélet bukásával összefüggésben.
A kémiában mindig az entalpiaváltozást használjuk, amelyet ΔH-ként ábrázolunk.
A hőt elnyelő kémiai reakciókat endotermnek nevezzük, és ΔH > 0.
Azokat a kémiai reakciókat, amelyek hőt bocsátanak ki, exotermnek nevezik, és ΔH < 0.
Videó lecke az entalpiáról
Mi az entalpia?
Az entalpia, amelyet mindig H képvisel, kezdetben az volt Josiah Willard Gibbs amerikai fizikus határozta meg, amelyet állandó nyomású hő függvénynek nevezett, mivel az ő szavaival élve:
„[…] a funkció csökkenése minden olyan esetben, amikor a nyomás nem változik, a rendszer által leadott hőt jelenti.”
Ne hagyd abba most... A reklám után van még valami ;)
Gibbs munkája alapján tehát az entalpiát termodinamikai függvényként foghatjuk fel, amelynek változása számszerűen megegyezik a rendszerben kicserélt hőmennyiséggel nyomás állandó. Ez azt jelenti, hogy az izobár folyamatokban (mint a legtöbb kémiai folyamatban) tudva kiszámítja az entalpiafüggvény változását, így megtudhatja a rendszer és a rendszer közötti hőcsere értékét szomszédság.

Az ilyen korreláció a hő okozza sok diák tévesen azt gondolja, hogy az entalpia a szinonimája hőség vagy valami, mint az energiatartalom, a hőtartalom, a felszabaduló hő és az elnyelt hő, és hasonlók.
Az entalpia a kalóriaelmélet összeomlásával összefüggésben merült fel, amely a hőt egy mérhetetlen anyagi anyagként kezelte, amely a melegebb testekből a hidegebb testekbe került. Így szükség volt egy új hőszámítási eszközre. A megoldás tehát az volt, hogy olyan mennyiségeket használtunk, amelyeknek már definiált termodinamikai egyenletei voltak, mint például az entalpia.
Olvasd el te is: Hogyan kell kiszámítani az oldat entalpiaváltozását?
entalpia variáció
Mivel az entalpia egy kémiai folyamat során kicserélt hő kiszámítására szolgáló eszköz, nincs értelme abszolút, izolált számként használni, hanem változását figyelembe véve, vagyis a gyakorlatban csak azt kell felmérnünk, hogy számszerűen mennyit változott az entalpia a kémiai folyamat során, hiszen a termodinamika biztosítja, hogy variáció az számszerűen megegyezik a folyamat során felszabaduló vagy elnyelt hővel.
Szigorúan véve az entalpia variációt a következőképpen határozhatjuk meg:
ΔH = HVégső - Ha kezdeti
A kémiai folyamatokhoz hasonlóan az utolsó lépésnek a termékek, a kezdeti lépésnek pedig a reagensek tekinthetők. Az entalpia-változás definícióját gyakran a következőképpen látják:
ΔH = HTermékek - Hreagensek
Gyakorlati és értelmezési szempontból ha az entalpia változás pozitív (ΔH> 0), azt mondjuk, hogy a kémiai reakció az endoterm, vagyis az egész folyamat során hőfelvétel történik. Már ha az entalpia változás negatív (ΔH< 0), azt mondjuk, hogy a kémiai reakció az hőtermelő, vagyis az egész folyamat során hő szabadul fel.
Az entalpia változása sok esetben grafikonokon látható, amint az a következő példákban látható.
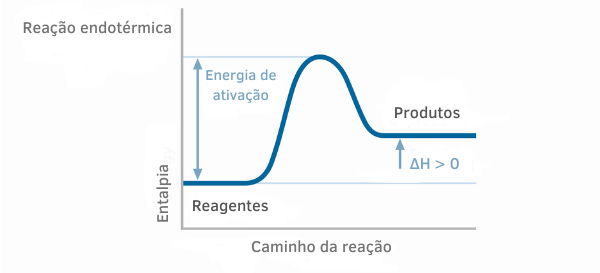
1. példa:
Endoterm reakció diagram
Az endoterm reakciók entalpiagrafikonjain látható, hogy a termékek entalpiájának mennyisége nagyobb, mint a reaktánsoké, ami azt jelzi, hogy a reakció mentén pozitív az eltérés. Így ha ΔH > 0, akkor azt mondhatjuk, hogy a kémiai folyamat hőelnyeléssel ment végbe.
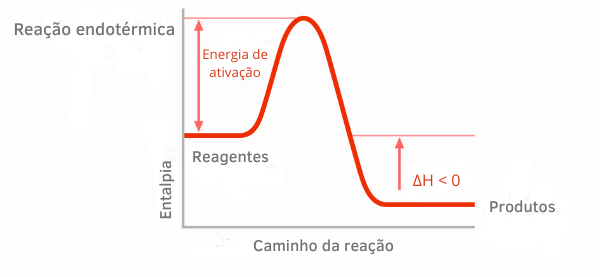
2. példa:
Exoterm reakció diagram:
Az exoterm reakciók entalpiagrafikonjain látható, hogy a termékek entalpiájának mennyisége kisebb, mint a reaktánsoké, ami azt jelzi, hogy a reakció mentén a változás negatív. Így, mivel ΔH < 0, azt mondhatjuk, hogy a kémiai folyamat hőkibocsátással ment végbe.
Olvasson többet a kémiai reakciók osztályozásáról a szövegben: FORendoterm és exoterm folyamatok.
Az entalpia típusai
képződési entalpia
AZ képződési entalpia é számított alapján kémiai reakciók kialakulása, amelyek olyan reakciók, amelyek során szobahőmérsékleten és 1 atmoszféra nyomáson a legstabilabb egyszerű anyagaikból egy mól összetett anyag keletkezik.
H2(g) + ½ O2 (g) → H2O (l) H°f = -286 kJ/mol
A képződésentalpiának az a nagy előnye, hogy a szobahőmérsékleten és 1 atmoszféra nyomáson stabilabb egyszerű anyagok entalpiája nullával megegyezik. Ez nem azt jelenti, hogy valójában nullák, de az egyszerűsítés és a jobb osztályozás kedvéért így kezelik őket.
Lény H = HTermékek - Hreagensek, ha figyelembe vesszük, hogy Hreagensek = 0, azt mondhatjuk, hogy a megfigyelt ΔH értéke csak a termékekre vonatkozik, amelyek ezekben az esetekben mindig egy mól vegyületből állnak. Ezért ezt az értéket a vízképződés standard entalpiaváltozataként adjuk meg, amelyet ΔH° képviself.
Ezzel a módszertannal számos anyagnak megvolt a maga változata standard entalpia formációs táblázatok, amint azt alább láthatjuk.
Anyag |
Képződési entalpia (ΔH°f) kJ/mol-ban |
CO2 (g) |
-393,4 |
CaO(k) |
-634,9 |
HI(g) |
+25,9 |
NEM (g) |
+90,1 |
kötési entalpia
A kötési entalpia arra szolgál, hogy jelezze, mekkora energia vesz részt egy adott mól felszakadásában vagy kialakulásában. kémiai kötés.
Az érthető, a kémiai kötés megszakításához hő elnyelésére van szükség, így a kötő atomok növelik a belső energia és ennek következtében növeli a mozgási energiát. nagyobbal kinetikus energia, az atomok intenzívebben rezegnek, aminek következtében a kötések megszakadnak. Így minden kötésszakadás endoterm folyamat.
Ellenkező esetben a kémiai kötés kialakításához az atomok elveszítik a mozgás szabadságát, és csökkenteni kell mozgási fokukat, csökkentve kinetikai energiájukat. A tartalék energia ezután hő formájában szabadul fel. És így, minden kötésképződés exoterm folyamat.
Az alábbi táblázat az egyes kémiai kötésekhez kapcsolódó energiák értékeit mutatja.
Kapcsolat |
Kötési energia (kJ/mol) |
C-H |
412,9 |
C-C |
347,8 |
O═O |
497,8 |
F-F |
154,6 |
NEM |
943,8 |
Vegye figyelembe, hogy az értékekben nincsenek előjelek, mivel modulusban vannak. Ennek az az oka, hogy a jelet Önnek kell hozzárendelnie attól függően, hogy a kapcsolat megszakadt vagy létrejött.
Égési entalpia
AZ égési entalpia jelzésére szolgál egy mól anyag elégetésekor felszabaduló hőmennyiség. Meg kell jegyezni, hogy minden égési reakció exoterm, mivel minden égés hőt bocsát ki.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2A ΔH°Ç = -889,5 kJ/mol
Az alábbi táblázat egyes vegyi anyagok égési entalpiaértékeit mutatja.
Anyag |
Égési entalpia (ΔH°Ç) kJ/mol-ban |
Etanol - C2H5Ó (1) |
-1368 |
benzol - C6H6 (1) |
-3268 |
Oktánszám - C8H18 (1) |
-5471 |
Glükóz - C6H12O6 (s) |
-2808 |
Fizikai állapotváltozás entalpiája
A fizikai állapot minden változása hőcserével jár. Ezért a a fizikai állapot változásának entalpiája jelzésére szolgál a fizikai állapotváltozási folyamatokban részt vevő hőmennyiség.
Például van vízpárologtatásunk:
H2O (1) → H2O (g) ΔH = +44 kJ/mol
A víz megolvadásakor a következőket kapjuk:
H2O(s) → H2O (l) ΔH = +7,3 kJ/mol
Az entalpia értékek szimmetrikusak az inverz folyamatokra, ami azt jelenti, hogy például a víz cseppfolyósításában az entalpiaváltozás -44 kJ/mol, míg a megszilárdulásában -7,3 kJ/mol.
Olvasd el te is: Mi az entrópia?
Entalpiával kapcsolatos gyakorlatokat oldott meg
1. kérdés - (UERJ 2018) Az üzemanyagként használt szénhidrogén szennyezőképességét a felszabaduló energia és a CO mennyiségének aránya határozza meg.2 teljes égésénél keletkezik. Minél nagyobb az arány, annál kisebb a szennyezőképesség. Az alábbi táblázat négy szénhidrogén szokásos égési entalpiáját mutatja.

A táblázatból a legkisebb szennyezőképességű szénhidrogén:
Oktán
hexán
Benzol
pentán
Felbontás
Alternatíva D
A kérdés azt jelzi, hogy a szennyezőképességet a felszabaduló energia és a CO mennyisége közötti arányként (hányadosként) határozzuk meg.2 teljes égésénél keletkezik. Minél nagyobb a ok, annál kisebb a szennyezőképesség, azaz több energia szabadul fel egy mol CO-ra2 generált.
A teljes égési reakciók Szénhidrogének idézve a következők:
Oktán: Ç8H18 +25/2 O2 → 8 CO2 + 9 óra2Az ok: 5440/8 = 680
hexán: Ç6H14 +19/2 O2 → 6 CO2 + 7 óra2Az ok: 4140/6 = 690
Benzol: Ç6H6 + 15/2 O2 → 6 CO2 + 3 H2Az ok: 3270/6 = 545
pentán: Ç5H12 + 8 O2 → 5 CO2 + 6 H2Az ok: 3510/5 = 702
Ebből arra következtethetünk, hogy a pentán a legkisebb szennyezőképességű szénhidrogén.
2. kérdés – (Enem 2015) Az erdőmaradványok felhasználása napról napra vonzóbbá válik, hiszen megújuló energiaforrást jelentenek. Az ábra egy fahulladékból kinyert bioolaj elégetését ábrázolja, ahol ΔH1 az entalpia változása 1 g bioolaj elégetése miatt, ami szén-dioxidot és folyékony vizet eredményez, valamint ΔH2 1 g víz gáz halmazállapotú folyékony halmazállapotúvá történő átalakulásával járó entalpiaváltozás.

Az entalpia változása kJ-ban 5 g bioolaj elégetésekor, ami CO-t eredményez2 (gáznemű) és H2A (gáznemű) a következő:
A) -106
B) -94
C) -82
D) -21.2
E) -16.4
Felbontás
Alternatív C
A bemutatott grafikonból ΔH-t kaptunk1 mint a CO-t termelő bioolajégetés entalpiaváltozata2 (g) és H2O (1) és ΔH2 mint a víz cseppfolyósításának entalpiaváltozása, mivel a CO2 gáz halmazállapotú marad és csak a fizikai állapota a Víz változások (gázból folyadékba).
A gyakorlat 5 g bioolaj elégetésekor az entalpia változását kéri, ami CO-t eredményez2 (gáznemű) és H2O (gáz halmazállapotú). A diagramból ez az entalpiaváltozás a következőképpen definiálható: ΔH = ΔH1 – H2. Így a ΔH értéke -16,4 kJ/g lesz. Ez a variáció, amint azt az egységben láthatjuk, MINDEN gramm bioolajra vonatkozik. 5 grammnál meg kell tennünk a arány:
1 g bioolaj -16,4 kJ
5 g bioolaj x
1. x = 5. (-16,4)
x = -82 kJ
Ezután megjelölhetjük a C alternatívát.
Írta: Stéfano Araújo Novais
Kémia tanár