A szerves vegyületeket többféleképpen ábrázolhatjuk, például lapos szerkezeti képlettel, egyszerűsített vagy sűrített szerkezeti képlettel vagy szaggatott képlettel. A legegyszerűbb ábrázolás azonban a molekulaképlet segítségével történik.

Tehát nézzük meg, hogyan határozható meg a szerves vegyületek molekulaképlete a többi fent említett képlet alapján.
1. A lapos szerkezeti képlettel:ez a képlet az atomok elrendezését vagy elrendezését mutatja a molekulán belül. Az alábbiakban például a benzinben jelenlévő egyik szénhidrogén lapos szerkezeti képlete látható.

Vegye figyelembe, hogy ebben a képletben az összes atom és a köztük lévő összes létező kötés megjelenik. Most, ennek a vegyületnek a molekulaképletének meghatározásához csak számolja meg az egyes elemek atomjainak számát, és helyezzen el egy indexet a kérdéses elem jobb alsó sarkába.
Fontos kiemelendő szempont az a szerves vegyületek molekulaképletét mindig a szén elemből kezdjük, mivel ezeknek az anyagoknak a fő összetevője. Lásd a példát:
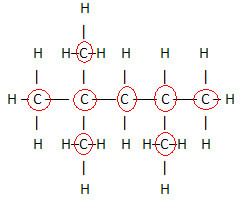
Mivel 8 szénatom van, így kezdjük el írni a molekulaképletet: Ç8
A képlet kitöltéséhez megszámoljuk a hidrogének mennyiségét:
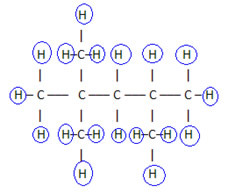
ezért a te molekuláris képlet é Ç8H18.
2. Az egyszerűsített vagy sűrített szerkezeti képlet segítségével: ebben a képlettípusban a hidrogének mennyiségét lerövidítjük. Például nézze meg ugyanazt a képletet a benzinben található molekulára, most sűrített formában:
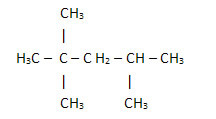
Így még egyszerűbb megszámolni a hidrogének mennyiségét, csak össze kell adni az indexeket (3 +3+ 3 +2 +1 +3 +3 = 18).
De most nézzük a linolsav sűrített szerkezeti képletét, amely olyan zöldségekben létezik, mint a gyapot, szójabab, napraforgó stb. és amelyet festékekben és lakkokban használnak:
H3C─CH2CH2CH2CH2CH═CH─CH2CH═CH─CH2CH2CH2CH2CH2CH2CH2─COOH
A szénatomok, hidrogének és oxigének mennyiségét számolva a következőket kapjuk molekuláris képlet linolsav: Ç18H32O2.
3. Az ütési képlet segítségével: ez a képlet tovább egyszerűsíti a szerves vegyületek ábrázolását, mivel kihagyja a C, CH, CH csoportokat2 és CH3.
Példa erre a linolsav molekula, nézze meg, hogyan néz ki:

Először számoljuk meg a szénatomok mennyiségét, ne feledjük, hogy ebben a képletben minden szénatom közötti kötést kötőjel jelöl. Így a csúcsok, valamint a két inflexiós pont szénatomoknak felel meg.
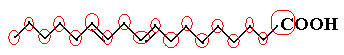
Tehát nekünk van: Ç18
Most, hogy megszámoljuk a hidrogének mennyiségét, emlékeznünk kell arra, hogy a szénatomok és a hidrogének közötti kötések magukban foglalják, mivel a szénről ismert, hogy négy kötést alkot; így a hiányzó kötések mennyisége az adott elemhez kötődő hidrogén mennyisége.
Lásd az alábbi magyarázatokat:
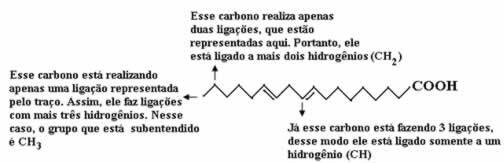
Így a hidrogének mennyisége: 32.

Az oxigén mennyiségét meglehetősen egyszerű megszámolni, mivel csak kettő van. Mivel a molekuláris képlet é: Ç18H32O2.
Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/formulas-moleculares-compostos-organicos.htm
