Az anyagok molekulái nem mind egyenesek, mintha egyetlen síkban lennének. Hiszen szétszóródtak a térben, és atomjaik különböző elrendezéseket vagy elrendezéseket vesznek fel. Így az egyes anyagtípusok molekuláihoz különböző geometriai alakzatok tartoznak.
A molekulák geometriájának meghatározásának egyik legegyszerűbb módja az elméleten alapul vegyértékhéj-elektronpárok taszítása (RPECV). Ezen elmélet szerint a központi atom elektronpárjai úgy működnek elektronikus felhők amelyek taszítják egymást. Ily módon a lehető legtávolabb helyezkednek el egymástól. A molekuláris geometria a központi atom körüli elektronpárok számától függ.
Ez az elektronikus felhő olyan elektronokból állhat, amelyek részt vesznek a kötésekben (egyszeres, kettős vagy hármas), és olyan elektronokból is, amelyek nem vesznek részt. Tehát nekünk van:
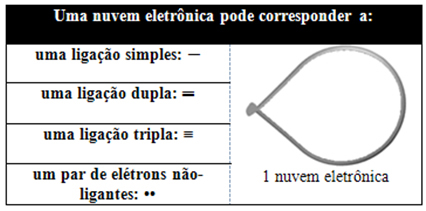
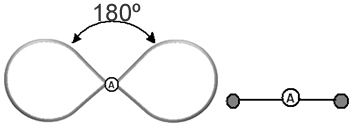
Hasznos, ha erre a felhőre úgy gondolunk, mint egy lekötött léggömbre vagy léggömbökre, amelyek középpontjában a központi atom áll. Például egy olyan molekulában, amelynek csak két elektronfelhője van a központi atom körül, annál nagyobb A köztük lévő lehetséges távolság 180°-os szög, és ennek következtében a molekula geometriája lineáris.
Ezért következtetést vonhatunk le arra vonatkozóan, hogy milyen lesz a legtöbb molekula molekula geometriája, ha figyelembe vesszük a a molekulákban lévő atomok száma és a központi atom által létrehozott kötések, ellenőrizve, hogy vannak-e párjai elektronok.
Lásd az alábbi példákat:
- 2 atomos molekulák: mindig lesznek lineáris
Például:
H─H, H─Cl, F─F, O═O, C≡O.
- 3 atomos molekula: szögletes vagy háromszög alakú
ha a központi atom nem kötő elektronpárral rendelkeznek a geometria lesz szögletes, mint az SO-molekula esetében2:
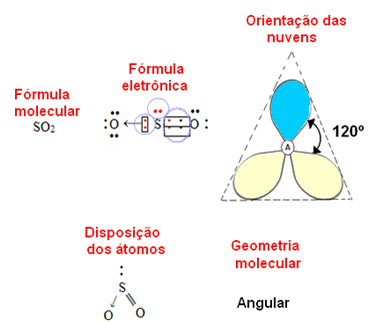
Tekintsük a kék elektronfelhőt olyan elektronpároknak, amelyek nem vesznek részt a kötésekben, a sárga pedig olyan elektronpárokat, amelyek részt vesznek a kötésekben.
- 4 atomos molekula: sík trigonális (vagy háromszög alakú) vagy piramis (vagy trigonális piramis)
Ha a központi atomnak nincs párosítatlan (nem kötődő) elektronpárja, akkor a molekuláris geometria lapos trigonális (vagy háromszög alakú). Nézd meg a BF példát3:

Ha az atomban vannak nem kötő elektronpárok, akkor a molekula geometriája piramis (vagy trigonális piramis) lesz, mint az ammónia esetében:

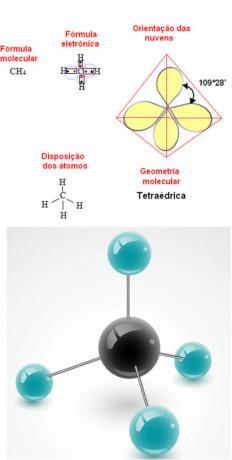
- 5 atomos molekula: tetraéderes
Példa a metán geometriára:
- 6 atomos molekula: trigonális bipiramis vagy háromszög alakú piramis.
Ilyen például a foszfor-pentaklorid (PCl5), amelynek néhány kapcsolata van a foszfor és a klór között 90°-os, míg mások 120°-os szögben, háromszög alappal bipiramist alkotva:
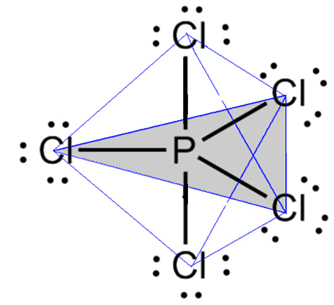
- 7 atomos molekula: oktaéderes
Példa: kén-hexafluorid (SF6), amelynek szögei 90°.

Írta: Jennifer Fogaça
Kémia szakon végzett
Forrás: Brazil iskola - https://brasilescola.uol.com.br/quimica/determinacao-geometria-das-moleculas.htm

